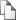Исследование цитотоксической активности и взаимодействия с компонентами клеточных мембран конъюгатов амфифильных полимеров с янтарной кислотой
На правах рукописи
Бондарь Оксана Викторовна ИССЛЕДОВАНИЕ ЦИТОТОКСИЧЕСКОЙ АКТИВНОСТИ И ВЗАИМОДЕЙСТВИЯ С КОМПОНЕНТАМИ КЛЕТОЧНЫХ МЕМБРАН КОНЪЮГАТОВ АМФИФИЛЬНЫХ ПОЛИМЕРОВ С ЯНТАРНОЙ КИСЛОТОЙ 03.01.04 – биохимия автореферат диссертации на соискание ученой степени кандидата биологических наук
Казань – 2013
Работа выполнена на кафедре биохимии и в научно-образовательном центре фармацевтики Федерального государственного автономного образовательного учреждения высшего профессионального образования "Казанский (Приволжский) федеральный университет"
Научный консультант: кандидат биологических наук Абдуллин Тимур Илдарович
Официальные оппоненты: доктор биологических наук, доктор химических наук, профессор Зайцев Сергей Юрьевич (Московская государственная академия ветеринарной медицины и биотехнологии им. К.И. Скрябина, заведующий кафедрой органической и биологической химии) доктор биологических наук, профессор Чернов Владислав Моисеевич (ФГБУН "Казанский институт биохимии и биофизики КНЦ РАН", заведующий лабораторией молекулярных основ патогенеза)
Ведущая организация: Государственное образовательное учреждение высшего профессионального образования "Казанский государственный медицинский университет"
Защита состоится "20" июня 2013 г. в 13. 00 на заседании Диссертационного совета Д 212.081.08 при Казанском (Приволжском) федеральном университете по адресу: г.
Казань, ул. Кремлевская, д. 18, главное здание, аудитория 211.
С диссертацией можно ознакомиться в Научной библиотеке им. Н.И. Лобачевского Казанского (Приволжского) федерального университета по адресу: г. Казань, ул.
Кремлевская, д. 35.
Автореферат разослан " " мая 2013 г.
Ученый секретарь Диссертационного совета, доктор биологических наук, профессор З.И. Абрамова
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы Синтетические полимерные системы представляют значительный интерес для биологии и медицины в качестве переносчиков биологически активных веществ (БАВ) in vitro и in vivo (Brinkhuis et al., 2011). В последние годы все большее внимание исследователей привлекают неионогенные амфифильные полимеры, способные обратимо изменять конформацию и активность биологических компонентов – липидных мембран, мембранных транспортеров и ферментов (Sandanaraj et al., 2005;
Firestone et al., 2005). К числу наиболее изученных амфифильных полимеров относятся блоксополимеры этиленоксида (ЭО) и пропиленоксида (ПО) состава (ЭО)х–(ПО)у–(ЭО)х, которые состоят из центрального относительно гидрофобного полипропиленоксидного блока, фланкированного гидрофильными блоками из ЭО. Подобные блоксополимеры известны под торговыми марками "Полоксамеры" или "Плуроники" (Chiappetta et al., 2007).
В водных растворах молекулы плуроников агрегируют с образованием наноразмерных мицелл, имеющих гидрофобное ядро и гидрофильную оболочку, и в которые могут быть инкапсулированы лекарственные средства для улучшения их растворимости, времени циркуляции в крови и доставки к биомишени (Letchford et al., 2007). Другие актуальные медицинские приложения плуроников включают создание тканеинженерных матриксов, компонентов искусственной крови (Kelly et al., 1998), иммунологических адъювантов (Newman et al., 1998), протекторов клеточных мембран (Maskarinec et al., 2002).
Весомый вклад в исследование биологической активности плуроников внесли А.
Кабанов и соавт., которые показали, что наряду с функцией доставки БАВ, плуроники способны проявлять эффекторные свойства и модулировать некоторые биохимические процессы в клетках млекопитающих. В зависимости от гидрофильно липофильного баланса (ГЛБ) и критической концентрации мицеллообразования (ККМ) плуроники воздействуют на различные сигнальные пути, например, активируют NF-B и проапоптотические факторы (Yang et al., 2005), влияют на биосинтез энергетических метаболитов (Kabanov et al., 2003), проницаемость клеточных мембран (Жирнов и др., 2006) и активность обратных мембранных транспортеров (Batrakova et al., 2004).
Особый интерес представляет применение плуроников в качестве эффекторов транспорта БАВ в опухолевые клетки, обладающие множественной лекарственной устойчивостью (МЛУ) (Kabanov et al., 2002). В настоящее время композиция плуроников L61 и F127 с доксорубицином (SP1049C) проходит 3-ю стадию клинических испытаний в качестве препарата для терапии солидных опухолей (Valle et al., 2011). Несмотря на достигнутые в этой области успехи, актуальной задачей остается разработка более активных и менее токсичных эффекторов внутриклеточной доставки БАВ на основе амфифильных полимеров. Перспективными подходами в решении подобной задачи являются модификация двухфункциональных плуроников анионными фрагментами, а также поиск новых полифункциональных блоксополимеров ЭО и ПО. В рамках предлагаемых подходов нами исследованы конъюгаты неионогенных плуроников с дикарбоновой кислотой, а также трехфункциональные блоксополимеры на основе глицерина – структурные аналоги природных жиров.
Целью настоящей работы является исследование биологических свойств новых полифункциональных блоксополимеров этиленоксида и пропиленоксида и их конъюгатов с янтарной кислотой в качестве эффекторов мембранного транспорта БАВ.
Были поставлены следующие задачи:
1. Получить конъюгаты двух- и трехфункциональных блоксополимеров этиленоксида и пропиленоксида с янтарной кислотой и изучить их мицеллообразующие свойства в физиологических условиях.
2. Провести сравнительное исследование взаимодействия неионогенных блоксополимеров и их анионогенных конъюгатов с плазматической мембраной клеток млекопитающих;
оценить эффект полимеров на проницаемость мембраны для низкомолекулярных веществ и биомакромолекул.
3. Установить влияние конъюгации с янтарной кислотой на цитотоксичность блоксополимеров для нетрансформированных и опухолевых клеток, индукцию апоптоза и метаболическую активность клеток.
4. Исследовать эффекторные свойства неионогенных блоксополимеров и их конъюгатов с янтарной кислотой на каталитическую активность Na+/K+ АТФ-азы и мембранного Р-гликопротеина, а также внутриклеточный транспорт биологически активных веществ.
Научная новизна работы:
Предложен подход к модулированию цитотоксичности и эффекторных свойств неионогенных блоксополимеров этиленоксида и пропиленоксида посредством их конъюгации с янтарной кислотой.
Предложено использование трехфункциональных блоксополимеров этиленоксида и пропиленоксида на основе глицерина в качестве эффекторов внутриклеточного транспорта БАВ.
Разработан способ характеристики плазматической мембраны клеток млекопитающих при взаимодействии с амфифильными полимерами методом динамического светорассеяния в режиме электрокинетических измерений.
Получены количественные данные о внутриклеточном накоплении и цитотоксичности композиций новых полифункциональных блоксополимеров ЭО и ПО с БАВ, а также об эффекте полимеров на проницаемость плазматической мембраны клеток млекопитающих и каталитическую активность Na+/K+ АТФ-азы и мембранного Р-гликопротеина (MDR-1).
По результатам работы подана заявка на патент РФ № "Трехфункциональные блоксополимеры этиленоксида и пропиленоксида для доставки активных веществ в живые клетки".
Практическая значимость Предложенные полимерные системы могут быть использованы в биохимии, клеточной биологии и биотехнологии в качестве регуляторов активности мембраносвязанных ферментов. Результаты работы представляют интерес для профилактической токсикологии и создания эффективных лекарственных композиций на основе амфифильных полимеров.
Разработанные биоэлектрохимические методы, основанные на определении мембранных потенциалов и редокс-активных метаболитов, позволяют исследовать процессы взаимодействия веществ и материалов с компонентами клеточных мембран.
Трехфункциональные блоксополимеры этиленоксида и пропиленоксида и их конъюгаты с янтарной кислотой являются перспективными эффекторами внутриклеточного транспорта субстратов обратных мембранных транспортеров и могут быть использованы для повышения эффективности известных лекарственных средств, в частности, противоопухолевых препаратов.
Апробация работы Основные результаты работы доложены на 5-ом Международном симпозиуме по перспективам нанобиотехнологии и наномедицины «NANOTR-5» (Анадолу, Турция, 2009), 1-ой Международной летней школе «Наноматериалы и нанотехнологии в живых системах» (Московская область, 2009), 1-ой Международной научно практической конференции «Постгеномные методы анализа в биологии, лабораторной и клинической медицине» (Москва, 2010), 6-ой Международной конференции по нанонаукам и нанотехнологии «NANOTR-6» (Измир, Турция, 2010), 10-ой научной конференции молодых ученых, аспирантов и студентов научно образовательного центра КФУ «Материалы и технологии XXІ века» (Казань, 2010), 4 ой Международной конференции IMBG молодых ученых «Молекулярная биология:
успехи и перспективы» (Киев, Украина, 2011), Международной конференции «Медицинские устройства и углеродные материалы: здоровье и защита окружающей среды» (Брайтон, Великобритания, 2011), 3-ей Международной научно-практической конференции «Постгеномные методы анализа в биологии, лабораторной и клинической медицине» (Казань, 2012), 1-ом Междисциплинарном симпозиуме «Молекулярная онкология: от лаборатории к медицине» (Киев, Украина, 2012), 3-ей Международной интернет-конференции «Актуальные проблемы биохимии и бионанотехнологии» (Казань, 2012).
Публикации По материалам диссертации опубликованы 5 статей и 10 тезисов докладов.
Структура и объем диссертации Диссертационная работа изложена на 183 страницах и состоит из введения, обзора литературы, описания материалов и методов исследования, результатов и их обсуждения с 29 рисунками и 8 таблицами, выводов и списка цитируемой литературы, включающего 234 ссылки.
Положения, выносимые на защиту:
1. Конъюгация неионогенных блоксополимеров этиленоксида и пропиленоксида с янтарной кислотой модулирует их взаимодействие с компонентами плазматической мембраны клеток и понижает цитотоксическую активность.
2. Применение трехфункционального блоксополимера этиленоксида и пропиленоксида на основе глицерина в качестве эффектора внутриклеточного транспорта биологически активных веществ.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ В работе использовали блоксополимеры этиленоксида и пропиленоксида:
двухфункциональные плуроники L61 и L121 (Sigma-Aldrich) и трехфункциональный лапрол 6003-2Б-18 (ТУ 2226-020-10488057-94, ОАО «Нижнекамскнефтехим»).
Конъюгаты полимеров с янтарной кислотой получали в реакции с янтарным ангидридом (Acros Organics). Наличие карбоксильных групп в конъюгатах подтверждали методами кислотно-основного титрования, ИК спектроскопии (по появлению полосы при 1750 см-1) и С ЯМР спектроскопии (по появлению сигнала 172 м.д.).
Культивирование клеток. Клетки аденокарциномы эпителия шейки матки (HeLa) и клетки аденокарциномы легкого человека (A549) культивировали в стандартных условиях (37С, 5%СО2) в среде DMEM, содержащей эмбриональную бычью сыворотку 10%, 2 мМ L-глутамин, 100 мкг/мл стрептомицин, 100 Ед/мл пенициллин. Фибробласты, выделенные из эксплантов кожи человека, культивировали в среде -MEM.
Анализ взаимодействия полимеров с плазмалеммой. Влияние амфифильных полимеров на характеристики плазматической мембраны клеток исследовали в буферных растворах в диапазоне концентраций полимеров от 0.05 до 1 мг/мл. Дзета потенциал клеток регистрировали методом динамического рассеяния света в режиме электрокинетических измерений на анализаторе ZetaSizer NanoZS (Malvern Instruments). Клетки суспендировали в 50 мМ буфере HEPES (рН 7.4) и инкубировали 10 мин в присутствии полимеров.
Изменение микровязкости плазмалеммы под действием полимеров оценивали по величине поляризации флуоресценции дифенилгексатриена (1 мкМ) в суспензии клеток (2106 клеток/мл) в фосфатно-солевом буфере (ФСБ). Гемолиз эритроцитов человека и высвобождение лактатдегидрогеназы из клеток А549 после инкубации с полимерами (4 часа, 37С) детектировали, соответственно, по содержанию гемоглобина при 540 нм и НАДН2 при 340 нм в надосадочной жидкости. Оптические измерения проводили на микропланшетном анализаторе Infinite 200 PRO (Tecan).
Величину трансмембранного потенциала плазмалеммы клеток (0. клеток/мл) оценивали по флуоресценции индикатора 500 нМ DiOC5(3) (3',3' дипентилоксокарбоксицианин иодида) на проточном цитофлуориметре Guava® easyCyte™ 6-2L Base System (Millipore).
Исследование влияния полимеров на метаболическую активность клеток и индукцию апоптоза. Содержание АТФ в лизатах клеток HeLa после их культивирования с полимерами определяли по величине тока окисления при потенциале +1.17 В (отн. Ag/AgCl) с помощью модифицированных сенсоров (Сайфуллина и др., 2012).
Величину мембранного потенциала митохондрий и количество апоптотических/некротических клеток после культивирования с полимерами оценивали методом проточной цитометрии, соответственно, по флуоресценции нМ TMRE (этилового эфира тетраметилродамина) и конъюгата аннексин V-Cy3 (по протоколу производителя – BioVision).
Анализ цитотоксичности полимеров и их влияния на накопление БАВ в клетках. Фибробласты кожи и клетки А549 культивировали 72 часа в присутствии полимеров или 6 часов в присутствии композиций полимеров с доксорубицином (100 мкМ) в стандартных условиях. Количество жизнеспособных клеток в культуре определяли с помощью метаболического индикатора 0.5 мг/мл МТТ (Sigma-Aldrich);
продукт восстановления МТТ клетками детектировали спектрофотометрически при 550 нм. Вычисляли концентрацию полимеров (IC50), при которой происходит ингибирование пролиферации клеток на 50% относительно контроля.
Для анализа внутриклеточного транспорта клетки инкубировали в присутствии композиций полимеров (0.2 мг/мл) с доксорубицином (50 мкМ) или родамином (2.5 мкМ) 20 минут и промывали центрифугированием. Накопление и локализацию веществ в клетках исследовали с помощью проточной цитометрии и лазерной сканирующей конфокальной микроскопии (Leica TCP SP2, Leica Microsystems).
Исследование эффекта полимеров на активность мембранных транспортеров. Использовали изолированные мембраны клеток Spodoptera frugiperda (линия Sf9), гиперэкспрессирующие человеческий рекомбинантный Р гликопротеин (Sigma-Aldrich). Мембраны эритроцитов человека, обогащенные Na+/K+ АТФ-азой, выделяли ультрацентрифугированием, согласно литературной методике (Simat et al., 1984). Реакцию проводили при 37С в буферном растворе, содержащем 0.2 и 6.0 мг/мл белка для Р-гликопротеина и Na+/K+ АТФ-азы соответственно, и 0. мг/мл полимера. В качестве стандартных эффекторов использовали винбластин, уабаин и ортованадат натрия (Sigma-Aldrich). Образующийся неорганический фосфат выявляли с помощью молибдата аммония при 880 нм на анализаторе Infinite 200 PRO (Tecan).
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ Мицеллообразующие свойства амфифильных полимеров и их конъюгатов Двухфункциональные плуроники (L61 и L121) и трехфункциональный лапрол 6003-2Б-18 на основе глицерина (далее по тексту лапрол 6003) модифицированы янтарной кислотой с получением анионогенных конъюгатов. По данным кислотно основного титрования модифицированный плуроник L61 содержит в своем составе один, а модифицированные плуроник L121 и лапрол 6003 – по два фрагмента янтарной кислоты. Химическая структура полученных конъюгатов полимеров с янтарной кислотой, обозначенных соответственно L61-M, L121-M и лапрол 6003-М, приведена на рисунке 1.
В зависимости от кон центрации и температуры амфифильные полимеры могут находиться в форме отдельных молекул (унимеров), агрегатов (мицелл), а также в форме отдельной фазы, что следует учитывать при исследовании их биологических свойств. По данным динамического рассея ния света, исходные неионо генные полимеры (плуроники L61, L121, лапрол 6003) и их Рис. 1. Структурные формулы конъюгатов плуроника L61 (x, y – 2.3, 31), плуроника L121 (x, y – 5, 68.3) и конъюгаты с янтарной кисло лапрола 6003 (x, y – 4.8, 18.5) с янтарной кислотой.
той образуют в ФСБ агрегаты, гидродинамический диаметр которых варьируется от 30 до 250 нм. После модификации полимеров дзета-потенциал их агрегатов существенно увеличивается с –7 до –60 мВ (рН 7.4), очевидно, вследствие появления анионных фрагментов янтарной кислоты на поверхности полимерных мицелл.
С использованием флуоресцентого индикатора пирена, чувствительного к гидрофобному микроокружению, установлена критическая концентрация мицеллообразования (ККМ) полимеров. Значения ККМ (мг/мл) в ФСБ уменьшаются в ряду: плуроник L61 (0.55), L61-М (0.12), лапрол 6003 (0.07), лапрол 6003-М (0.05), плуроник L121 (0.02), L121-М (0.01). Это показывает, что наличие фрагмента янтарной кислоты повышает гидрофобность модифицированных полимеров, особенно, конъюгата плуроника L61, характеризующегося меньшей молекулярной массой и относительно высоким значением ККМ.
Методом динамического рассеяния света оценено влияние компонентов питательной среды DMEM с сывороткой на мицеллообразование амфифильных полимеров и их конъюгатов. В питательной среде все исследуемые полимеры, кроме плуроника L61, образуют более компактные мицеллы, чем в ФСБ, по-видимому, вследствие стабилизирующего влияния белков сыворотки на полимерные агрегаты. В случае плуроника L61 компоненты DMEM, напротив, способствуют появлению массивных агрегатов, вероятно, вследствие включения белков в состав мицелл этого полимера.
Взаимодействие амфифильных полимеров и их конъюгатов с плазматической мембраной Взаимодействие исследуемых полимеров с плазмалеммой клеток млекопитающих охарактеризовано по их адсорбции на клеточной поверхности, встраиванию в липидный бислой и изменению проницаемости мембраны. Поскольку белки питательной среды оказывают стабилизирующее влияние на клеточную мембрану, измерения проводили в модельных буферных растворах.
Нами разработан способ оценки дзета-потенциала клеток млекопитающих с помощью динамического рассеяния света в режиме электрокинетических измерений, который позволяет выявлять изменения в биохимическом составе плазматической мембраны в норме и при индукции апоптоза (Сайфуллина и др., 2012;
Бондарь и др., 2012). Клетки человека характеризуются отрицательными значениями дзета потенциала (), генерируемого ионогенными компонентами клеточной поверхности (табл. 1).
На рисунке 2 показана динамика изменения клеток HeLa при инкубации с амфифильными полимерами в различных концентрациях. Неионогенные плуроник L121 и лапрол 6003 вызывают сильное понижение дзета-потенциала клеток пропорционально концентрации полимеров вплоть до –9.3±0.8 и –5.9±0.7 мВ соответственно, что свидетельствует о связывании этих полимеров с поверхностью клеток.
Сходные по величине, но противоположные по знаку изменения наблюдаются при инкубации клеток с модифицированными плурониками L121-М и L61-М, которые усиливают отрицательный клеток до величины –39.5±5.0 и –44.2±4. соответственно. Обработка клеток HeLa модифицированным лапролом 6003-М сопровождается незначительным повышением на 5 мВ (рис. 2). Наблюдаемое увеличение дзета-потенциала клеток свидетельствует об адсорбции конъюгатов амфифильных полимеров с янтарной кислотой на клеточной поверхности, что сопровождается появлением дополнительных анионных групп на границе плазмалемма/раствор.
Таблица 1. Значения дзета-потенциала () клеток человека, суспендированных в 50 мМ буфере HEPES (рН 7.4), по данным динамического рассеяния света.
Клетки, мВ –21.3 ± 1. HeLa Фибробласты кожи –23.2 ± 1. Мононуклеары –21.9 ± 0. Эритроциты –31.8 ± 1. Кривая распределения клеток Липосомы –62.3 ± 1.5 HeLa (0.5106/мл) (фосфатидилхолин) В отличие от других исследуемых полимеров неионогенный плуроник L приводит к относительно малым изменениям клеток HeLa, что указывает на слабое связывание этого полимера с клеточной поверхностью, вероятно, вследствие особенностей его мицеллообразующих свойств.
Лапрол - Дзета-потенциал, мВ L - - L Рис. 2. Изменение дзета-потенциала - клеток HeLa, обработанных амфифиль -25 Лапрол-M ными полимерами и их конъюгатами.
Плотность суспензии 0.5106 клеток/мл, - Т 37С, HEPES буфер (pH 7.4).
- L121-M - L61-M - - 0 20 40 60 80 100 120 140 160 180 C, мкг/мл Для оценки способности амфифильных полимеров к дестабилизации клеточной мембраны регистрировали изменения поляризации флуоресценции липофильного индикатора дифенилгексатриена, распределенного в липидной фазе плазмалеммы клеток. Величина поляризации флуоресценции, пропорциональная микровязкости мембраны, понижается при повышении ее текучести в результате дестабилизации липидного бислоя (Lande et al., 1995). Установлено, что неионогенные и модифицированные плуроники вызывают уменьшение микровязкости плазмалеммы;
влияние полимеров возрастает в ряду: плуроник L61/L61-M, плуроник L121/L121-M, лапрол 6003, лапрол 6003-М (рис. 3).
Поляризация флуоресценции, отн. ед.
Рис. 3. Изменение поляризации флуо ресценции дифенилгексатриена в клетках A549 при инкубации с амфифильными полимерами и их конъюгатами (1 мг/мл).
Плотность суспензии 2106 клеток/мл, Т 37С, ФСБ (pH 7.4).
л ль M M -M L ро л 1 L ро L ро ап L нт Л ап Ко Л Поскольку микровязкость плазмалеммы существенно влияет на ее проницаемость для низкомолекулярных соединений, включая ионы (Lande et al., 1995), нами изучено влияние амфифильных полимеров на трансмембранный потенциал клеток A549 с использованием индикатора DiOC5(3), накапливающегося в клетках пропорционально величине электрохимического градиента мембраны (Haugland et al., 2002).
В результате инкубации с исследуемыми полимерами наблюдается появление групп клеток, имеющих повышенный трансмембранный потенциал и частично деполяризованных по сравнению с необработанными клетками (рис. 4).
Неспецифический характер гиперполяризации клеток в присутствии полимеров вероятно обусловлен способностью блоксополимеров ЭО и ПО к связыванию катионов металлов (Krylova et al., 2004). Появление клеток с пониженным трансмембранным потенциалом, по-видимому, вызвано повреждением плазмалеммы (рис. 4).
Рис. 4. Распределение флуоресценции индикатора DiOC5(3) (0.5 мкМ) в клетках A549 при инкубации с амфифильными полимерами и их конъюгатами (0.1 мг/мл). Указано количество деполяризованных клеток в процентах.
Исследовано влияние амфифильных полимеров и их конъюгатов на проницаемость плазматической мембраны клеток для некоторых белков.
Установлено, что в концентрации 0.1 мг/мл все исследуемые полимеры ингибируют спонтанный выход гемоглобина из эритроцитов, а также секрецию лактатдегидрогеназы интактными клетками А549 (рис. 5А). Исходя из литературных данных (Moloughney et al., 2012), можно предположить, что плуроники, адсорбируясь на поверхности клеток, способны стабилизировать плазмалемму при повреждении и, тем самым, уменьшать ее проницаемость для макромолекул.
В концентрации 1 мг/мл плуроник L61 и лапрол 6003 усиливают гемолиз в 24 и 1.5 раза соответственно, тогда как плуроник L121 достоверно не влияет на выход гемоглобина из эритроцитов (рис. 5Б). Это показывает, что в концентрациях выше ККМ плуроник вызывает солюбилизацию плазмалеммы, по-видимому, L вследствие высокой гидрофобности на фоне меньшей молекулярной массы плуроника L61 по сравнению с плуроником L121 и лапролом 6003.
Следует отметить, что в отличие от исходных неионогенных полимеров конъюгаты не только не вызывают повреждение мембраны эритроцитов, но даже способны к ингибированию спонтанного гемолиза (рис. 5Б). Можно сделать вывод, что конъюгация амфифильных полимеров с янтарной кислотой приводит к значительному изменению характера их взаимодействия с клеточной мембраной.
Основываясь на данных динамического рассеяния света (табл. 1), мы полагаем, что значительный отрицательный заряд мицелл конъюгатов способствует их электростатическому отталкиванию от плазматической мембраны.
Таким образом, взаимодействие неионогенных амфифильных полимеров с клеточной мембраной существенно зависит от их мицеллообразующих свойств.
Полимеры в форме унимеров способны вызывать тонкие и разнонаправленные эффекты на плазмалемму и, в частности, изменять ее проницаемость для ионов (рис.
4). Введение анионного фрагмента в блоксополимеры ЭО и ПО посредством конъюгации с янтарной кислотой уменьшает их мембраноповреждающее действие (выше ККМ), что, в частности, показано для плуроника L61, тестируемого в составе противоопухолевого препарата (Valle et al., 2011).
Б А 0, Гемолиз эритроцитов, % Активность ЛДГ, Ед/л 0, 0, 0, 0, 0, 0, ль л -M M M ь -M л М M L ро ол ро 1 L л ро л 1 L L L ап ро L тр ро ап нт L L Л он ап Л Ко ап Л K Л Рис. 5. Влияние амфифильных полимеров и их конъюгатов на высвобождение лактатдегидрогеназы из клеток А549 (А) и гемолиз эритроцитов (Б). Клетки инкубировали 4 часа при 37С в ФСБ в присутствии полимеров в концентрации 0.1 мг/мл для (А) и 1. мг/мл для (Б). Степень гемолиза выражали в процентах относительно полного лизиса эритроцитов тритоном Х-100 (100%).
Влияние амфифильных полимеров и их конъюгатов на метаболическую активность клеток и индукцию апоптоза С использованием метаболического MTT-теста исследована цитотоксичность неионогенных амфифильных полимеров и их конъюгатов с янтарной кислотой в отношении клеток А549 и фибробластов кожи при культивировании. В таблице приведены значения цитотоксических концентраций полимеров, ингибирующих рост клеток на 50% Исследуемые полимеры ингибируют пролиферацию (IC50).
опухолевых клеток А549 в большей степени, чем первичных фибробластов кожи.
Цитотоксичность неионогенных полимеров уменьшается в ряду: плуроник L61, плуроник L121, лапрол 6003. В частности, IC50 лапрола 6003 для фибробластов почти в 10 раз меньше, чем в случае плуроников L61 и L121 (табл. 2).
Конъюгаты плуроников и лапрола с янтарной кислотой характеризуются меньшей цитотоксичностью, чем исходные неионогенные полимеры (табл. 2).
Модификация плуроника L61, плуроника L121 и лапрола 6003 приводит к увеличению их IC50 для клеток А549 соответственно в 1.4, 1.6 и 3.8 раза. Для фибробластов наблюдается сходное понижение цитотоксичности полимеров после модификации, за исключением плуроника L61, конъюгация которого с янтарной кислотой приводит к незначительному понижению IC50 (табл. 2).
Табл. 2. Цитотоксические концентрации (IC50, мкг/мл) амфифильных полимеров и их конъюгатов.
Полимер Фибробласты кожи Клетки A Плуроник L61 37.4 ± 3.1 6.2 ± 0. Плуроник L61-M 28.7 ± 6.0 9.0 ± 0. Плуроник L121 21.4 ± 7.8 9.3 ± 3. Плуроник L121-M 265.7 ± 192.6 15.4 ± 8. Лапрол 6003 352.7 ± 58.7 20.7 ± 6. Лапрол 6003-М 707.8 ± 66.3 79.5 ± 6. Для получения дополнительной информации о жизнеспособности и метаболической активности клеток при культивировании с полимерами исследовано их влияние на внутриклеточное содержание АТФ, трансмембранный потенциал митохондрий и распределение фосфатидилсерина в составе плазмалеммы клеток.
Содержание АТФ в клеточных лизатах определяли с помощью разработанного ранее электрохимического сенсора, сигнал которого при характерном потенциале +1.2 В пропорционален содержанию АТФ в клетках (Shakhmaeva et al., 2011). Установлено, что после 2-часовой инкубации с клетками HeLa плуроники L61, L121 и лапрол вызывают уменьшение внутриклеточной концентрации АТФ соответственно на 65, и 28% (рис. 6). Конъюгация полимеров с янтарной кислотой уменьшает их ингибирующее действие на биосинтез АТФ, что наиболее выражено для модифицированного плуроника L61 (почти в 3 раза).
С использованием проточной цитометрии исследовано распределение в клетках флуоресцентных индикаторов – накапливающегося в митохондриях TMRE, пропорционально их мембранному потенциалу (Haugland et al., 2002), а также аннексина специфически связывающегося с фосфатидилсерином на V-Cy3, поверхности апоптотических клеток (Galluzzi et al., 2009). 13-часовое культивирование клеток A549 с плуроником L61 и его конъюгатом (0.5 мг/мл) сопровождается уменьшением среднеканальной флуоресценции TMRE соответственно в 2.8 и 1.7 раза (рис. 7А, 1 и 2) вследствие понижения потенциала митохондриальной мембраны. В тех же условиях плуроники L61 и L61-М вызывают появление соответственно 29.3 и 9.1% клеток, выявляемых индикатором аннексин V Cy3 (рис. 7Б, 1 и 2).
Ток, мкА 0.5 A 2, 2, 1, 1,1 1,2 1, Потенциал, мВ 1, Рис. 6. Отклик электрохимического сенсора на АТФ в лизатах клеток HeLa после культивирования в присутствии амфи 0, фильных полимеров и их конъюгатов.
Концентрация полимеров 0.5 мг/мл, время 0, культивирования 2 часа. Вставка: вольтам ль -М М л М L ро л 1 L ро перограмма окисления АТФ, адсорбирован L ро ап L нт ап Л Ко ного на поверхности сенсора.
Л В отличие от плуроника L61, исходный плуроник L121 и его конъюгат не понижают потенциал митохондрий в клетках даже при более длительном культивировании (24 часа) и большей концентрации – 1 мг/мл (рис. 7A, 3 и 4). При этом плуроники L121 и L121-М индуцируют появление соответственно 31.8 и 7.0% клеток, позитивных по аннексину V-Cy3 (рис. 7Б, 3 и 4). В тех же условиях (1 мг/мл, 24 часа) лапрол 6003 и его конъюгат не вызывают деполяризации мембраны митохондрий и появления апототических и некротических клеток (рис. 7А и Б, 5 и 6).
Результаты показывают, что плуроник L61 оказывает более выраженное негативное воздействие на метаболические процессы в клетках по сравнению с плуроником L121 и лапролом 6003. Высокую активность плуроника L61 можно объяснить как его прямым мембраноповреждающим действием, так и опосредованным влиянием на внутриклеточные мишени. Принимая во внимание, что компоненты питательной среды стабилизируют плазмалемму клеток при повреждении полимерами, мы полагаем, что цитотоксические свойства плуроника обусловлены, преимущественно, его эффективным внутриклеточным L проникновением. Проникнув в клетку, плуроник дестабилизирует L митохондриальную мембрану, индуцирует апоптоз (рис. 7А и Б) и ингибирует биосинтез АТФ (рис. 6), что согласуется с данными литературы (Kabanov et al., 2002;
Batrakova et al., 2001).
В отличие от плуроников, лапрол 6003 в меньшей степени воздействует на метаболическую активность и индуцирует апоптоз в условиях эксперимента.
Конъюгация плуроников и лапрола с янтарной кислотой понижает их цитотоксическую активность (рис. 6 и 7, табл. 2). Относительно низкая цитотоксичность неионогенного лапрола и анионогенных конъюгатов амфифильных полимеров, вероятно, обусловлена особенностями их внутриклеточного транспорта, выяснение которых требует самостоятельного исследования.
Рис. 7. Распределение флуоресценции 100 нМ TMRE (А) и аннексина V-Cy3 в клетках A после культивирования в присутствии амфифильных полимеров и их конъюгатов. Указаны среднеканальные значения флуоресценции (А) и количество окрашенных аннексином V-Cy клеток (Б) в процентах.
Влияние полимеров на АТФ-азную активность мембранных транспортеров и транспорт БАВ Амфифильные полимеры протестированы в качестве эффекторов транспорта БАВ в опухолевые клетки. Оценена способность неионогенных полимеров и их конъюгатов усиливать цитотоксичность модельного противоопухолевого препарата доксорубицина, используемого в композиции с полимером, для клеток А549 и HeLa.
Концентрацию компонентов композиции выбирали таким образом, чтобы доксорубицин вызывал лишь частичное понижение жизнеспособности опухолевых клеток, а эффекторы не проявляли собственной цитотоксичности.
Установлено, что как неионогенные полимеры, так и их анионогенные конъюгаты достоверно усиливают цитотоксичность доксорубицина в различной степени, однако, имеющаяся выборка данных не позволяет выявить зависимости эффекта полимеров от их структуры (табл. 3). Сходным эффекторным действием обладает верапамил – конкурентный ингибитор мембранного Р-гликопротеина.
Результаты также показывают, что конъюгация неионогенных полимеров с янтарной кислотой существенно не уменьшает цитотоксическую активность композиций с доксорубицином (табл. 3).
Табл. 3. Жизнеспособность клеток А549 и HeLa, культивируемых 6 часов в присутствии композиций доксорубицина (100 мкМ) с амфифильными полимерами (200 мкМ) и верапамилом (100 мкМ), по данным MTT-теста.
Композиция Жизнеспособность (% отн. контроля) доксорубицина с A549 HeLa эффектором Контроль (без 83.5 ± 7.0 75.5 ± 1. эффектора) Верапамил 57.9 ± 10.1 64.8 ± 7. Плуроник L61 55.7 ± 3.0 45.8 ± 2. Плуроник L61-M 57.5 ± 5.7 61.2 ± 4. Плуроник L121 67.1 ± 7.0 46.1 ± 0. Плуроник L121-M 78.6 ± 11.6 34.0 ± 16. Лапрол 6003 79.1 ± 9.1 34.7 ± 7. Лапрол 6003-М 74.7 ± 12.2 47.5 ± 11. По данным флуоресцентной микроскопии исследуемые полимеры не влияют на внутриклеточное распределение доксорубицина, накапливающегося преимущественно в ядре, но способствуют некоторому повышению интенсивности его флуоресценции в обработанных композициями клетках (в 1.2–1.7 раза) (рис. 8А).
Сходные результаты получены с использованием проточной цитометрии, по данным которой как неионогенные, так и модифицированные полимеры увеличивают внутриклеточное накопление цитостатика (рис. 8Б).
Рис. 8. Изменение флуоресценции доксорубицина в клетках А549 после 2-часовой инкубации с композициями доксорубицина (50 мкМ) с амфифильными полимерами (0.2 мг/мл) по данным флуоресцентной микроскопии (А) и проточной цитометрии (Б). Для (А): 1 – контроль (доксорубицин без эффектора);
2 – плуроник L61-М;
3 – плуроник L121-M;
4 – лапрол 6003 М. Для (Б) указаны среднеканальные значения флуоресценции.
Дополнительно с помощью проточной цитометрии исследован опосредованный полимерами внутриклеточный транспорт родамина 123 – модельного субстрата мембранного Р-гликопротеина (Varma et al., 2003). Обнаружено, что исходные неионогенные полимеры увеличивают среднюю интенсивность флуоресценции родамина 123 в клетках A549 после соинкубации с полимерами в 2.2 (плуроник L61), 4.3 (плуроник L121) и почти в 8 раз (лапрол 6003) по сравнению с контролем (рис. 9).
Конъюгаты плуроника L121 и лапрола 6003 с янтарной кислотой в большей степени усиливают накопление родамина 123 в клетках, чем неионогенные полимеры (в 9.4 и 11.2 раза соответственно). Конъюгация плуроника L61, напротив, сопровождается некоторым уменьшением внутриклеточной аккумуляции индикатора, опосредованной полимером (рис. 9).
Наблюдаемое повышение чувствительности опухолевых клеток к доксорубицину и аккумуляции в них родамина 123 в присутствии амфифильных полимеров (табл. 3, рис. 8 и 9) может являться следствием неспецифического повышения проницаемости плазматической мембраны и/или ингибирования процессов обратного транспорта веществ из клетки. С использованием флуоресцентного производного верапамила (верапамил-BODIPY®FL) установлено, что клетки А549 и HeLa характеризуются повышенной активностью обратных мембранных транспортеров по сравнению с первичными фибробластами.
Рис. 9. Распределение интенсивности флуоресценции родамина 123 (2.5 мкМ) в клетках А549, обработанных его композициями с амфифильными полимерами (0.2 мг/мл). Время инкубации 15 мин. Указаны среднеканальные значения флуоресценции.
Для выяснения способности полимеров к ингибированию обратных транспортеров использовали изолированные клеточные мембраны, гиперэкспрессирующие Р-гликопротеин человека – один из ключевых факторов развития МЛУ у опухолевых клеток, а также мембраны эритроцитов, обогащенные Na+/K+ АТФ-азой. На рис. 10 приведены данные по общей АТФ-азной активности транспортеров в присутствии ингибиторов.
Установлено, что исходные неионогенные полимеры значительно ингибируют АТФ-азную активность Р-гликопротеина и, в меньшей степени, Na+/K+ АТФ-азы. При этом степень ингибирования увеличивается в ряду: плуроник L61, плуроник L121, лапрол 6003 (рис. 10), что согласуется со способностью полимеров изменять микровязкость плазматической мембраны (рис. 3). При этом переход от неиногенных полимеров к анионогенным конъюгатам не сопровождается значимым изменением их ингибирующей активности.
Данные литературы (Batrakova et al., 2004) позволяют предположить, что понижение активности мембранных транспортеров в присутствии исследуемых полимеров обусловлено их опосредованным влиянием на липидное микроокружение транспортеров. Выявленный эффект амфифильных полимеров и конъюгатов с янтарной кислотой согласуется с их влиянием на внутриклеточную доставку модельных БАВ в опухолевые клетки (рис. 8 и 9). Таким образом, обратный мембранный транспортер P-гликопротеин является вероятной мишенью исследуемых полимеров в клетках.
Б 1, А 0, Активность, Ед/л Активность, Ед/л 0,4 1, 0,3 0, 0, 0, 0, 0, 0, 0, VO M он л -M l M он M л -M M C ро L L 1 ро л л L -K 1 Ф L Ф L a ап ро ро L ап N L L Л ап ап Л Л Л Рис. 10. Влияние амфифильных полимеров и их конъюгатов на АТФ-азную активность Na+/K+ АТФ-азы мембран эритроцитов (А) и мембранного Р-гликопротеина человека (Б).
Концентрация полимеров 0.1 мг/мл.
Как показывают результаты проведенного исследования, неионогенные блоксополимеры ЭО и ПО на основе глицерина и их анионогенные конъюгаты с янтарной кислотой являются перспективными эффекторами внутриклеточного транспорта БАВ. На фоне плуроников, трехфункциональный лапрол проявляет большее ингибирующее действие на АТФ-азную активность транспортеров в составе плазматической мембраны. Введение в состав плуроников и лапрола анионного фрагмента повышает совместимость амфифильных полимеров с клеточными мембранами, значительно уменьшает их цитотоксические эффекты и индукцию апоптоза. Полученные результаты служат основой создания безопасных полимерных систем – эффекторов внутриклеточной доставки биологически активных веществ.
ВЫВОДЫ 1. Двухфункциональные (плуроники L61, L121) и трехфункциональный (лапрол 6003) блоксополимеры этиленоксида и пропиленоксида модифицированы янтарной кислотой с получением анионогенных конъюгатов состава 1 : 1, 1 : 2 и 1 : 2 соответственно. Модификация сопровождается уменьшением критической концентрации мицеллообразования блоксополимеров и придает их мицеллам сильный отрицательный заряд в физиологических условиях.
2. Неионогенные блоксополимеры и их конъюгаты с янтарной кислотой при адсорбции на плазматической мембране клеток млекопитающих способны вызывать ее гиперполяризацию, ингибировать высвобождение лактатдегидрогеназы и гемоглобина из клеток вследствие стабилизации мембраны. Выше значений ККМ неиногенные блоксополимеры проявляют заметное мембраноповреждающее действие, а введение в них анионного фрагмента ингибирует повреждение плазмалеммы.
3. Цитотоксические эффекты блоксополимеров уменьшаются в ряду: плуроник L61, плуроник L121 и лапрол 6003. Модификация блоксополимеров янтарной кислотой понижает их цитотоксическую концентрацию в 1.5–2.5 раза, в значительной степени подавляет индукцию апоптоза и ингибирование биосинтеза АТФ в клетках, вероятно, вследствие замедления внутриклеточного транспорта анионогенных конъюгатов.
4. Неионогенные блоксополимеры проявляют ингибирующее действие на АТФ азную активность Na+/K+ АТФ-азы мембран эритроцитов и обратный мембранный транспортер Р-гликопротеин, которое увеличивается в ряду: плуроник L61, плуроник L121 и лапрол 6003. Модификация плуроника L121 и лапрола янтарной кислотой не влияет на их ингибирующую активность.
5. Трехфункциональный блоксополимер на основе глицерина (лапрол 6003) и его конъюгат с янтарной кислотой значительно усиливают накопление субстратов мембранного Р-гликопротеина в опухолевых клетках и представляют интерес для создания высокоэффективных противоопухолевых композиций.
СПИСОК РАБОТ, ОПУБЛИКОВАННЫХ ПО ТЕМЕ ДИССЕРТАЦИИ Публикации в журналах, рекомендованных ВАК:
1. Bondar, O.V. Conjugation of succinic acid to non-ionogenic amphiphilic polymers modulates their interaction with cell plasma membrane and reduces cytotoxic activity / O.V. Bondar, A.V. Sagitova, Y.V. Badeev, Y.G. Shtyrlin, T.I. Abdullin // Colloids and Surfaces B: Biointerfaces. – 2013. – V. 109. – P. 204-211.
Бондарь, О.В. Мембранотропные свойства конъюгатов блоксополимеров этилен 2.
и пропиленоксида с янтарной кислотой / О.В. Бондарь, А.В. Сагитова, Ю.В.
Бадеев, Ю.Г. Штырлин, Т.И. Абдуллин // Биологические мембраны. – 2013. – Т.30. – № 2. – С. 1-10.
3. Мартынова, А.Д. Улучшение доставки комплексов плазмидной ДНК с поликатионом в клетки человека в присутствии блоксополимеров этилен- и пропиленоксида / А.Д. Мартынова, В.Д. Шевченко, О.В. Бондарь, Т.И. Абдуллин // Клеточная трансплантология и тканевая инженерия. – 2012. – T.4. – № 3. – С.
101-104.
4. Бондарь, О.В. Мониторинг дзета-потенциала клеток человека при снижении их жизнеспособности и взаимодействии с полимерами / О.В. Бондарь, Д.В.
Сайфуллина, И.И. Мавлютова, Т.И. Абдуллин // Acta Naturae. – 2012. – Т.4. – № 1(12). – С. 99-102.
5. Abdullin, T.I. Pluronic block copolymer-mediated interactions of organic compounds with noble metal nanoparticles for SERS analysis / T.I. Abdullin, O.V. Bondar, Y.G.
Shtyrlin, M. Kahraman, M. Culha // Langmuir. – 2010. – V. 26. – P. 5153-5159.
Тезисы докладов и материалов конференций:
1. Abdullin, T. Characterization of Silver Colloid–Pluronic Composite Nanoparticles as Optical Probes for Cell Analysis / T. Abdullin, O. Bondar, M. Kahraman, M. ulha //
Abstract
of the 5th Symposium on Prospects in Nanobiotechnology & Nanomedicine “NANOTR-5”. – Anadolu University. – June 8-12. – 2009. – P.164.
2. Bondar, O.V. Plurunic-modified metal nanoparticles as optical probes for analysis of biomolecules and cells / O.V. Bondar, М. Kahraman, М. ulha, Yu.G. Shtyrlin, T.I.
Abdullin // 1st International summer school “Nanomaterials and nanotechnologies in living systems”. – Moscow. – June 29 - July 4. – 2009. – P.176-179.
3. Бондарь, О.В. Зонды на основе модифицированных наночастиц серебра для анализа клеточных метаболитов и транспорта лекарств / О.В. Бондарь, М. Чулха, Т.И. Абдуллин // І международная научно-практическая конференция «Постгеномные методы анализа в биологии, лабораторной и клинической медицине». – Москва. – 17-19 ноября. – 2010. – С.176.
4. Bondar, O. Extra-cellular Metabolites Probing Utilizing Composite Silver Nanoparticles and Surface-Enhanced Raman Spectroscopy / O. Bondar, M. Kahraman, T. Abdullin, M. ulha. // Abstract of the 6th Nanoscience and Nanotechnology Conference “NANOTR-6”. – Izmir. – June 15-18. – 2010. – P.478.
5. Бондарь, О.В. Новые носители лекарств на основе модифицированных плуроников / О.В. Бондарь, А.В. Сагитова, Т.И. Абдуллин // X Научная конференция молодых ученых, аспирантов и студентов научно-образовательного центра Казанского (Приволжского) федерального университета «Материалы и технологии XXІ века». – Казань. – 28-29 марта. – 2010. – С.21.
6. Bondar, O. Chemicalli modified ethylene oxide / propylene oxide block copolymers for drug delivery / O. Bondar, A. Sagitova, T. Abdullin // abstract book of 4th international IMBG conference for young scientists "Molecular biology: advances and perspectives".
– Kyiv, Ukrane. – September 14-17. – 2011. – P.147.
7. Bondar, O. Assessment of surface charge of human cells upon induction of apoptosis and interaction with nanomaterials using Malvern Zetasizer instrument / O. Bondar, D.
Saifullina, I. Mavlyutova, I. Shakhmaeva, T. Abdullin // Book of abstracts of international conference «Medical Devices and Carbon Materials: Health and Enviromental Protection». – Brighton, UK. – September 21-22. – 2011. – P.10.
8. Bondar, O. Multiple drug resistance overcoming by chemically modified pluronic block copolymers / O. Bondar, A. Sagitova, T. Abdullin // The 1st Multidisciplinary Symposium Molecular oncology: from laboratory bench to medicine. – Kyiv, Ukraine.
– September 17-22. – 2012. – C.95.
9. Бондарь, О.В. Эффекты конъюгатов амфифильных полиэфиров с янтарной кислотой на свойства биологических мембран / О.В. Бондарь, Н.А. Раджабова, Ю.В. Бадеев, Ю.Г. Штырлин, Т.И. Абдуллин // Материалы III международной научно-практической конференции «Постгеномные методы анализа в биологии, лабораторной и клинической медицине». – Казань. – Ноябрь 22-24. – 2012. – С.238.
10. Мартынова, А.Д. Исследование влияния блоксополимеров этилен- и пропиленоксида на доставку плазмидной ДНК в клетки человека / А.Д.
Мартынова, О.В. Бондарь, Т.И. Абдуллин // Материалы 3-й международной интернет-конференции «Актуальные проблемы биохимии и бионанотехнологии».
– Казань. – Ноябрь 19-22. – 2012. – С.197.
Благодарности Работа поддержана грантами: ФЦП (проект 14.A18.21.0113), РФФИ (проект 13 04-00889), грант Президента РФ (проект МК-6156.2013.4).
Выражаю глубокую благодарность директору НОЦ фармацевтики Штырлину Ю.Г., а также сотрудникам НОЦ фармацевтики и кафедры биохимии КФУ: Бадееву Ю.В., Салафутдинову И.И., Скибо Ю.В., Агафоновой М.Н., Сагитовой А.В. за всестороннюю помощь в подготовке диссертационной работы.
Просьба высылать отзывы на автореферат по адресу:
420008, г. Казань, ул. Кремлевская, д.18, главное здание КФУ, к 104В, отдел аттестации, ученому секретарю диссертационного совета Д 212.081.08 д.б.н., проф. Абрамовой З.И., факс: (843)238-76-01. E-mail автора: [email protected] С авторефератом диссертации можно ознакомиться на сайте КФУ