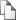Функциональная активность рибосомных генов у жителей курской области и вклад полиморфизмов генов факторов их транскрипции и генов ферментов биотрансформации ксенобиотиков в её формированиё
На правах рукописи
ТРУБНИКОВА ЕЛЕНА ВЛАДИМИРОВНА ФУНКЦИОНАЛЬНАЯ АКТИВНОСТЬ РИБОСОМНЫХ ГЕНОВ У ЖИТЕЛЕЙ КУРСКОЙ ОБЛАСТИ И ВКЛАД ПОЛИМОРФИЗМОВ ГЕНОВ ФАКТОРОВ ИХ ТРАНСКРИПЦИИ И ГЕНОВ ФЕРМЕНТОВ БИОТРАНСФОРМАЦИИ КСЕНОБИОТИКОВ В ЕЁ ФОРМИРОВАНИЁ 03.07.02 – генетика
АВТОРЕФЕРАТ
диссертации на соискание ученой степени доктора биологических наук
Москва – 2012 1
Работа выполнена на базах научно-исследовательской лаборатории «Генетика» Феде рального государственного бюджетного образовательного учреждения высшего профессио нального образования «Курский государственный университет» и лаборатории медицинской генетики кафедры биологии, медицинской генетики и экологии Государственного бюджетно го образовательного учреждения высшего профессионального образования «Курский госу дарственный медицинский университет» Министерства здравоохранения и социального раз вития Российской Федерации
Научный консультант:
доктор медицинских наук, профессор, акаде Иванов Владимир Петрович мик РАЕН, заслуженный деятель науки РФ, заведующий кафедрой биологии, медицин ской генетики и экологии ФГБОУ ВПО КГМУ Минздравсоцразвития РФ
Официальные оппоненты:
доктор биологиеских наук, профессор, заве Спицин Виктор Алексеевич дующий лабораторией экологической ге нетики Государственного учреждения МГНЦ РАМН Доктор медицинских наук, профессор, и.о.
Шипков Валерий Петрович заведующего кафедрой биологии и общей генетики ФГБОУ ВПО Российского уни верситета дружбы народов Доктор биологичексих наук, профессор, заве Шевелёв Алексей Борисович дующий лабораторией биоинженерии ФГБУ Института полиомиелита и вирусных эн цефалитов имени М.П.Чумакова РАМН
Ведущая организация:
Государственное бюджетное образовательное учреждение высшего профессионального обра зования «Белгородский государственный университет»
Защита состоится 26 декабря в часов на заседании диссертационного совета Д 212.203.05 в Российском университете дружбы народов по адресу: 117198, г. Москва, ул. Миклухо Маклая, дом 8.
С диссертацией можно ознакомиться в Научной библиотеке ФГБОУ ВПО «Российский уни верситет дружбы народов» по адресу: 117198, г. Москва, ул. Миклухо-Маклая, дом 6.
Автореферат разослан « » 2012 г.
Ученый секретарь диссертационного совета, кандидат биологических наук, доцент О.Б. Гигани
ОБЩАЯ ХАРАКТЕРИСТИКА РАБОТЫ
Актуальность проблемы Основой существования живых систем является обмен веществ и энергии, а также способность сохранять динамичное равновесие всех внутренних процессов вне зависимости от условий окружающей среды [Грин Н и др., 2005, Ярыгин В.Н., 2010].
При несогласовании внутренней координации нарушается установленный баланс и возникают различные патологические состояния, которые в некоторых случаях могут характеризоваться широким спектром симптомокомплексов [Бочков Н.П, 2002]. У человека одной из интегрирующих систем организма является кровеносная, которая реализует свои функции за счет составляющих [Воробьёв А.И., 1990]. Единственны ми клетками переферической крови, способными модифицировать собственный про лиферативный статус являются лейкоциты, из которых максимальное количество со ставляет группа лимфоцитов (от 25 до 50%) [Волкова М.А. 2001;
http://medbiol.ru/medbiol/immunology/0007a025.htm;
Кассирский, И.А. Алексеев, Г.А., 1990.;
]. Пролиферация и последующая дифференцировка, не зависимо от тканевой принадлежности, в любой клетке обеспечивается функционированием белоксинтети ческого аппарата, начиная с молекулы ДНК и заканчивая посттрансляционной моди фикацией [Вейко Н.Н., 2001, Газарян К.Г., 1983].
Существует большое количество механизмов, способных тем или иным обра зом изменять уровень белкового синтеза, среди которых выделяют три основные группы: регуляцию на этапе транскрипции, процессинга и трансляции [Сингер М, 1998;
Зайцева Г.Н., 1994, Мушкамбаров Н.Н., 2003, Заяц Г.Р., 2002]. Если в первом случае скорость в большей степени зависит от сохранности матрицы и от качествен ного и количественного состава факторов транскрипции, то во втором – от наличия соответствующих ферментов. В третьем – от количества функционирующих рибосом:
чем больше рибосом в клетке, тем больше количество белков [Сингер М, 1998]. Ин формация о нуклеиновом остове рибосом, в свою очередь, закодирована в последова тельности так называемых рибосомных генов, которые являются уникальными в сво ем роде [Прокофьева-Бельговская А.А., 1969, Ляпунова Н.А., 2001].
Рибосомные гены – это участки молекулы ДНК, у человека локализованные в парах акроцентрических хромосом [Ляпунова Н.А., 2001;
Захаров А.Ф., 1982;
Колча нова И.О., 2005] и кодирующие транскрипцию 45S предшественника рРНК (13 т.п.н.) [Мамаев Н.Н., 1992;
Worton RG, 1988].
В результате процессинга под действием рибонуклеаз из первичного транс крипта выщепляются три функциональные структуры - 28S, 18S и 5,8S рРНК, кото рые в комплексе с рибосомными белками и низкомолекулярной 5S [Тимофеева М.Я., 1993] рРНК формируют каркас малой и большой субъчастиц рибосомы [Сингер М, 1998].
На каждой хромосоме РГ собраны в кластеры, разделенные спейсерами, и мно гократно повторены [Зацепина О.В., 1995]. В период деления клетки эти участки не спирализуются, образуя вторичные перетяжки, и удерживают некоторые элементы комплекса транскрипции [Сабанеева Е.В., 1989]. В период интерфазы интенсивность их активности настолько высока, что в ядре они визуализируются как отдельные морфологические структуры – ядрышки [Созанский О.А., 1983], а соответствующие участки ДНК носят названия ядрышкообразующих районов [Зацепина О.В., 1988, Тимофеева М.Я., 1993].
Таким образом, именно функциональная активность рибосомных генов (ФАРГ), на базовом уровне, определяет интенсивность основного обмена.
Необходимость изучения механизмов – в целом и поиска факторов – в частно сти, способных модифицировать экспрессию РГ и потребность в дальнейшем расши рении представлений о состоянии генетического материала на фоне ухудшающейся экологической обстановки определили актуальность проведения настоящего исследо вания.
Цель исследования Изучить особенности комплекса показателей функциональной активности ри босомных генов у жителей Курской области и вклад полиморфизмов генов факторов их транскрипции и генов ферментов биотрансформации кенобиотиков в её формиро вание Задачи исследования 1. Изучить уровень функциональной активности рибосомных генов у русского населения Курской области Российской Федерации.
2. Рассмотреть особенности внутрикомплексного взаимодействия показателей функциональной активности рибосомных генов в курской популяции.
2. Сравнить уровень внутрикомплексной сопряженности показателей функцио нальной активности рибосомных генов при трех патогенетически самостоятельных группах мультифакториальных заболеваний: детских церебральных параличах, дет ских аллергозах (бронхиальной астме, атопическом дерматите и аллергическом рини те) и патологии дыхательной системы (хронической обструктивной болезни легких и профессиональном бронхите).
3. Изучить популяционную распространенность полиморфных вариантов генов факторов транскрипции рибосомных генов и генов ферментов биотрансформации ксенобиотиков среди русских жителей Курской области Российской Федерации.
4. Провести анализ ассоциаций полиморфизмов генов факторов транскрипции рибосомных генов и ферментов детоксикации с предрасположенностью к каждой из групп рассматриваемых мультифакториальных заболеваний.
5. Исследовать влияние полиморфизмов генов факторов транскрипции РГ и ферментов детоксикации на показатели функциональной активности рибосомных ге нов для здоровых жителей Курской области в различных возрастных группах и с уче том полового диморфизма, а также в пределах каждого из рассматриваемых заболе ваний.
6. Установить особенности проявления связей парных сочетаний генных мар керов с количественными характеристиками комплекса функциональной активности рибосомных генов в каждой из рассматриваемых групп.
7. Разработать концептуальную модель вовлеченности полиморфизма генов факторов транскрипции РГ и ферментов детоксикации в формирование модификаци онной изменчивости уровней функциональной активности рибосомных генов у чело века.
Научная новизна исследования Основным научным результатом исследования явилось впервые проведенное изучение внутрикомплексной взаимосвязи цитогенетических показателей функцио нальной активности рибосомных генов у человека, как в норме, так и при трех пато генетические самостоятельных группах мультифакториальных заболеваний: детских церебральных параличах, детских аллергозах (бронхиальной астме, атопическом дер матите и аллергическом рините) и патологии лёгких (хронической обструктивной бо лезни легких и профессионаном бронхите) на примере коренных жителей Курской области. Также впервые определена роль полиморфизмов генов факторов транскрип ции рибосомных генов и генов ферментов биотрансформации ксенобиотиков в фор мировании показателей функциональной активности рибосомных генов для рассмат риваемых групп. Впервые доказана зависимость уровня функциональной активности рибосомных генов от полиморфизмов изучаемых генов, как для здоровых, так и для больных жителей Курской области разных возрастных групп. Впервые установлены особенности влияния парных сочетаний генных маркеров на количественные харак теристики комплекса функциональной активности рибосомных генов при различных мультифакториальных патологиях. Впервые разработана концептуальная модель во влеченности полиморфизма генов факторов транскрипции рибосомных генов и генов ферментов биотрансформации ксенобиотиков в модификацию уровня функциональ ной активности рибосомных генов у человека. Впервые было установлено, что в ос нове формирования генетической предрасположенности к патогенетически самостоя тельным нозологическим формам мультифакториальных заболеваний лежат струк турно-функциональные особенности взаимодействия генов ферментов детоксикации и генов факторов транскрипции рибосомных генов, а также цитогенетических осо бенностей показателей функциональной активности рибосомных генов.
Научно-практическая значимость работы Результаты выполненной работы открывают новые перспективы для более глу бокого понимая процессов функционирования и регуляции транскрипционного ком плекса рибосомных генов у человека, для изучения цитогенетических и молекулярно генетических механизмов, посредством которых полиморфные варианты генов фак торов транскрипции рибосомных генов, а также ферментов детоксикации, вовлекают ся в развитие и патогенез не только детских церебральных параличей, детских аллер гозов, патологии лёгких, но и многих других распространенных мультифакториаль ных заболеваний. Для доклинической диагностики мультифакториальных заболева ний генетическое тестирование полиморфизмов генов факторов транскрипции рибо сомных генов и генов ферментов детоксикации ксенобиотиков в комплексе с цитоге нетическими характеристиками показателей функциональной активности рибосом ных генов позволяет не только выявить ключевые межгенные взаимодействия, но и идентифицировать спектр возможных средовых факторов, способных спровоцировать возникновение или обострение той или иной патологии.
Полученные в результате генетического тестирования данные могут быть при менены для определения подходов к профилактике мультифакториальной патологии в отягощенных семьях в рамках медико-генетического консультирования. Получен ная концептуальная модель вовлеченности полиморфизма генов факторов транскрип ции рибосомных генов и ферментов детоксикации в модификацию уровня функцио нальной активности рибосомных генов открывает широкие возможности для практи ческого применения элементов индивидуальной генотип-специфической терапии и профилактики широкого спектра мультифакториальных заболеваний, посредством контроля над потенциально регулируемыми средовыми факторами риска.
Полученные данные также представляют интерес для специалистов в области цитогенетики, генетики развития, молекулярной генетики, пренатальной генетиче ской диагностики, детской невропатологии и аллергологии, специалистов офтальмологов, терапевтов и профпатологов.
Полученные результаты рекомендуются к использованию при чтении специ альных курсов по медицинской и клинической генетике, биохимии, патофизиологии, внутренним болезням в вузах медицинского и медико-биологического профиля, а также на курсах повышения квалификации медицинских работников.
Основные положения, выносимые на защиту 1. Установлены показатели комплекса функциональной активности рибосом ных генов для жителей Курской популяции с учетом полового диморфизма и возрас тного состава.
2. Показатели функциональной активности рибосомных генов среди больных ДЦП, в группе с детскими аллергозами и при патологии лёгких характеризуются своими особенностями. У детей с ДЦП установлено снижение показаний функцио нальной активности рибосомных генов (18,69 у.е.) в сравнении с контролем (19, у.е.). Другие нозологические формы статистически значимо не отличались от популя ционных данных.
3. Частоты генотипов полиморфизмов генов TP53, DNMT3B, TAF1B, CYP1A1, EPHX1, GSTM1, GSTT1, GSTP среди жителей популяции Курской области и боль ными рассматриваемых нозологических форм (ДЦП, аллергозы и патология лёгочной системы).
4. Формирование ДЦП ассоциировалось с увеличением частоты вариантного аллеля С гена TAF1B;
предрасположенность к аллергозам с геном TP53;
патология легких – с аллельными вариантами двух полиморфных генов фактора транскрипции рибосомных генов TAF1B и EPHX.
5. Доказана связь изучаемых полиморфизмов факторов транскрипции рибосом ных генов и генов ферментов биотрансформации ксенобиотиков с отдельными цито генетическими показателями функциональной активности рибосомных генов как в общей популяции, так и среди больных отдельных нозологических форм.
6. Установлено влияние отдельных парных сочетаний исследуемых полимор физмов генов факторов транскрипции рибосомных генов и ферментов биотрансфор мации ксенобиотиков на показатели функциональной активности рибосомных генов, как в общей популяции, так и среди больных отдельных нозологических форм.
Внедрение в практику Результаты исследования внедрены в работу Курской областной детской кли нической больницы, лаборатории медицинской генетики кафедры биологии, меди цинской генетики и экологии Федерального государственного бюджетного образова тельного учреждения высшего профессионального образования «Курский государст венный медицинский университет» Министерства здравоохранения и социального развития Российской Федерации, научно-исследовательской лаборатории «Генетика» Федерального государственного бюджетного образовательного учреждения высшего профессионального образования Курского государственного университета, кафедры общей биологии Курского государственного университета, областной медико генетической консультации, научно-исследовательской лаборатории биохимии и мо лекулярно-генетического анализа Федерального государственного бюджетного учре ждения «Федеральный центр токсикологической, радиационной и биологической безопасности» (ФГБУ «ФЦТРБ-ВНИВИ»), в учебный процесс кафедры биологии и методики её преподавания Федерального государственного бюджетного образова тельного учреждения Высшего профессионального образования «Набережночелнин ский институт социально-педагогических технологий и ресурсов».
Апробация работы и публикации Результаты работы представлены на IV международной научно-практической конференции «Динамика научных достижений – 2005» (Днепропетровск, 2005), меж дународного научного форума «Ломоносов - 2005» (Москва, 2005), I Всероссийской конференции молодых учёных (Воронеж, 2007), IV международной медико практической конференции «Знание и технологии: взгляд в будущее – 2008» (Днеп ропетровск, 2008), итоговой научной сессии КГМУ и отделения медико биологических наук Центрально-Черноземного научного центра РАМН (Курск, 2005 2012), ежегодной Международной научной конференции молодых ученых медиков (Курск, 2005-2012), Международного медицинского конгресса студентов и молодых ученых (Тернополь, Украина, 2009), Международной конференции «Теоретические и прикладные проблемы социально-правовых, медико-биологических и технико экономических сфер жизни общества» (Курск, 2008, 2009), V Съезде Вавиловского Общества Генетиков и Селекционеров (Москва, 2009), Международной научно практической конференции «Актуальные проблемы биологии, нанотехнологий и ме дицины» (Ростов-на-Дону, 2009), Всероссийской конференции с международным уча стием «Охрана репродуктивного здоровья – будущее России» (Белгород, 2010), V Международной (XIV Всероссийской) Пироговской научной медицинской конферен ции студентов и молодых ученых (Москва, 2010), VI Съезда Российского общества медицинских генетиков (Ростов-на-Дону, 2010), II Всероссийской научно практической конференции с международным участием «Медико-биологические ас пекты мультифакториальной патологии», (Курск, 2011), IV международном моло дежном исследовательском конгрессе «Санкт-Петербургские научные чтения» (Санкт-Петербург, 2011 г.), Международной научно-практической конференции «Со временные проблемы и пути их решения в науке, транспорте, производстве и образо вании’2011» (Одесса, 2011), Международной научно-практической конференции «Современная медицина: тенденции развития» (Новосибирск, 2011), IV Республикан ской научно-практической конференции с международным участием студентов и мо лодых ученых «Проблемы и перспективы развития современной медицины» (Гомель, 2012). По материалам диссертации опубликовано 42 печатных работ, четыре моно графии. Диссертантом получен диплом на открытие.
Структура и объем диссертации Диссертация состоит из введения, обзора литературы, описания материалов и методов исследования, пяти глав результатов собственных исследований, заключе ния, выводов, библиографического списка и приложения. Работа изложена на страницах машинописного текста, содержит 53 таблицы и 22 рисунков. Библиогра фический список литературы включает 411 источников, 105 из которых на русском языке, 306 – зарубежные.
Личный вклад автора Диссертационная работа представляет собой законченный, самостоятельно вы полненный автором труд. Все представленные в диссертации результаты получены лично Трубниковой Е.В. на базе научно-исследовательской лаборатории «Генетика» ГБОУ ВПО «Курский государственный университет» (цитогенетическая часть) и ла боратории медицинской генетики кафедры биологии, медицинской генетики и эколо гии ГБОУ ВПО «Курский государственный медицинский университет» Минздрав соцразвития РФ (молекулярно-генетическая часть). Ею проведена комплексная стати стическая обработка и анализ сформированной базы данных, проанализированы оте чественные и зарубежные источники по теме диссертации, получены и обобщены ре зультаты исследования. В работах, выполненных в соавторстве, использованы ре зультаты исследований с долей личного участия автора от 75 до 85%.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ Материалом для исследования послужила популяционная выборка (n=1764) неродственных индивидов русских жителей Курской области Российской Федерации, которая включала в себя две крупные группы – детей (до 18 лет) и взрослых (от лет и старше). В рамках данных групп отдельно рассматривались выборки: детей с церебральными параличами (n=98), детей с аллергопатологией (n=397): с бронхиаль ной астмой (n=147), с атопическим дерматитом (n=130), аллергическим ринитом (n=120), и взрослых с патологией легких (n=351): больные с профессиональным хро ническим бронхитом (n=164) – стаж работы от 7 до 38 лет и больные с хронической обструктивной болезнью легких (n=187). Контрольная группа включала 918 относи тельно здоровых индивидов и также была разделена на детскую (n=223) и взрослую подгруппы (n=695). При формировании контрольной группы учитывалось отсутствие у индивида соответствующих заболеваний. Группы больных не отличались от кон трольной группы, как по полу, так и по возрасту (р0,05).
При выполнении экспериментальной части работы был использован комплекс ный подход, так что анализу подвергались и хромосомы, и ДНК, полученные из еди новременно взятого биологического материала обследуемых.
Цитогенетические методы Получение препаратов метафазных хромосом проводили по стандартным мето дикам с использованием полумикрометода [Захаров А.Ф., 1982]. Клеточные культуры фиксировали на 72 часу после стимуляции ФГА по стандартным методикам [Наза ренко С.А., 2003]. Полученную взвесь раскапывали на химически чистые охлажден ные стекла, высушивали, маркировали и хранили при комнатной температуре до ок рашивания [Рубцов Н.Б., 2006].
Для выявления ядрышковых организаторов использовался метод дифференци ального окрашивания хромосом, предложенный Howell и Black с некоторыми моди фикациями. Анализ комплекса показателей функциональной активности рибосомных проводился на 20 метафазных пластинках для каждого индивида без кариотипирова ния. Показатели функциональной активности рибосомных генов оценивались визу ально с помощью микроскопа «ZEISS» (увеличение окуляра 10, увеличение объекти ва 90) по пятибалльной шкале [Ляпунова Н.А., 2001].
Кроме оценки общей активности рибосомных генов, а также активности рибо сомных генов по хромосомам группы D и группы G, учитывался показатель числа ак тивных рибосомных цистронов (число окрашенных хромосом) и ассоциативная ак тивность (число ассоциаций акроцентрических хромосом и число хромосом, всту пивших в ассоциации).
Всего проанализировано 24 400 метафазных пластинок, из них 9740 – в выбор ке детей и 14660 – в выборке взрослых;
из них группа детского контроля – 2140, группа взрослого контроля – 10960, дети с ДЦП – 1740, дети с аллергозами – 5860 ме тафаз: с БА – 2280, с АД – 1860, АР – 1720, и больные с патологией лёгких – 3700 ме тафаз: больные с профессиональным ХБ – 2200, больные с ХОБЛ – 1500.
Молекулярно-генетические методы Выделение геномной ДНК осуществляли из замороженной (-20°С) венозной крови стандартным двухэтапным методом фенольно-хлороформной экстракции [Ма ниатис Т. С соавт., 1984]. Лейкоциты, осажденные дважды с PBS центрифугировани ем, лизировали в ТЕ-буфере протеиназой К в присутствии 0,4% додецилсульфата на трия. Клеточную суспензию инкубировали в течение ночи в термостате при темпера туре 42°С. Геномную ДНК экстрагировали из клеточного лизата в 3 этапа: сначала фенолом, насыщенным 10 мМ Трис-HCl (рН=8,0) (1:1), затем фенолом и хлорофор мом (по одному объему фенола и хлороформа на два объема надосадочной жидкости) и последний раз хлороформом (1:1). ДНК преципитировали 96% этанолом, высуши вали, растворяли в ТЕ-буфере, замораживали и хранили при -20°С. Амплификацию фрагментов ДНК методом полимеpазной цепной pеакции (ПЦР) проводили в 12 мкл реакционной смеси, содержащей 0,5 мкл образца геномной ДНК. Смесь для ампли фикации включала: 67 мМ Трис-HCl pH=8,8, 16,6 мМ сульфата аммония, 6,7 мкМ ЭДТА, 2,0-7,0 мМ MgCl2, 1 мМ -меркаптоэтанола, 1 мМ каждого dNTPs (dATP, dCTP, dTTP и dGTP), 15 нМ каждого из праймеров и 1 е.а. Taq-полимеразы. Ампли фикацию проводили на многоканальном термоциклере «Терцик» (НПО «ДНК Технология», Москва). Обработка продуктов ПЦР проводилась специфическими ре стриктазами согласно протоколам, описанным производителями ферментов. После инкубации рестрикционной смеси проводили разделение фрагментов ДНК с помо щью электрофореза. В зависимости от размера разделяемых фрагментов ДНК исполь зовали агарозный гель различной концентрации 0,8-3,5%, приготовленный на основе ТВЕ буфера (0,089 М Трис-НСl, 2 мМ ЭДТА, 0,089 М борная кислота), а также 6-8% ПААГ (соотношение акриламид : метиленбисакриламид 29 : 1). После электрофореза окрашенные этидиумбромидом гели визуализировали в проходящем ультрафиолето вом свете на приборе компьютерной видеосъемки GDS-8000 (UVP Inc, США) с по мощью программного аналитического пакета LabWorksTM v4.5 (США). В рамках проводи мого исследования изучали 3 полиморфизма 3 генов факторов транскрипции рибо сомных генов: Tp53 (R72P), DNMT 3B (C149T) и TAF 1B (A6C) и 6 полиморфизмов генов ферментов биотрансформации ксенобиотиков, обладающих антиоксидантной активностью: CYP1A1 (I462V), EPHX1 (Y113H, H139R), GSTM1 (0/+), GSTT1 (0/+), GSTP1 (I105V).
Генетико-статистические методы Формирование базы данных осуществлялось с использованием программы Statistica 6.0. Обработка данных осуществлялась по стандартным методикам вариационной статистики [Пирузян Л.А., 2000;
Кукес В.Г, 2004;
Esson K., 2004;
Amoli, K., 1998]. Математические расче ты проводились с помощью пакетов прикладных программ Statistica 6.0, MS Excel 2002.
Все полученные результаты проверяли на нормальность распределения с помощью критерия Шапиро-Уилка [Реброва О.Ю., 2003]. В связи с тем, что распределение полученных данных по некоторым показателям не соответствовало нормальному, при описании количе ственных признаков использовались: медиана признака (Ме), его квантили (Q25, Q75), ми нимальное и максимальное значения. При сравнении двух независимых групп по од ному признаку были использованы непараметрический критерий Манна-Уитни и [Реброва О.Ю., 2006]. При сравнении трех и более независимых групп был использо ван однофакторный дисперсионный анализ ранговых вариаций по Краскелу-Уолису и медианный тест. В случае отклонения нулевой гипотезы и принятии альтернативной (р0,05) проводили попарное сравнение групп с использованием теста Манна-Уитни, применяя поправку Бонферони при оценке значения р. При анализе взаимосвязей внутри пары количественных или порядковых качественных признаков использовал ся корреляционный анализ, по методу Спирмана и расчет критерия 2. Также был ис пользован линейно-дискриминантный анализ.
Для оценки соответствия распределений генотипов ожидаемым значениям при равно весии Харди-Вайнберга (РХВ) в выборке и сравнение с частотами аллелей и генотипов раз ных групп проводили с помощью критерия 2 Пирсона, при условии, когда объем выборки не превышал 10 случаев, использовали критерий 2 с поправкой Йетса [Вейр Б., 1995, Реброва О.Ю., 2003]. Об ассоциации аллелей или генотипов с предрасположенностью к заболе ваниям судили по величине отношения шансов (OR) – показателю, отражающему, во сколько раз вероятность оказаться в группе «случай» (больные) отличается от вероят ности оказаться в группе «контроль» (здоровые) для носителя изучаемого генотипа [Schlesselman J., 1982;
Pearce N., 1993].
Связь между цитогенетическими признаками и молекулярно-генетическими маркерами изучали с помощью однофакторного дисперсионного анализа, в рамках которого сравнивали распределегие значений количественных признаков в группах с различными генотипами с последующим попарным сравнением дисперсий (критерий Вальда-Вольфовитца) [Лакин, 1990]. Для анализа влияния парных сочетаний геноти пов на показатели комплекса ФАРГ был использован двухфакторный дисперсионный анализ с расчетом объясненной фенотипической дисперсии.
Во всех случаях уровень статистической значимости принимали за 95% (р 0,05). [Банержи А., 2007;
Гланц С., 1998;
Гржибовский А. М., 2008;
Chang Y. H., 2003;
Field A., 2005].
РЕЗУЛЬТАТЫ СОБСТВЕННЫХ ИССЛЕДОВАНИЙ 1. Изучение уровеня функциональной активности рибосомных генов у русского населения Курской области Российской Федерации Впервые на значительной выборке (n=655 человек) был определён уровень функциональной активности рибосомных генов для русского населения Центрально Чернозёмного региона России (таблица 1).
Таблица 1.
Уровень ФАРГ в общей популяции Курской области (N=655) Мean CI Признак Ме Q25- Q75 Min Max ±Std.dev. -95%– 95% ФАРГ 10 19,24 17,95 – 20,60 14,85 25,90 19,31±1,81 19,17 – 19, ФАРГ D 11,50 10,70 – 12,45 8,40 15,90 11,65±1,27 11,55 – 11, ФАРГ G 7,75 6,80 – 8,85 4,10 11,25 7,68±1,41 7,57 – 7, РЦ 8,50 8,10 – 9,00 4,10 10,00 8,52±0,72 8,47 – 8, AХр 0,70 0,55 – 1,00 0,00 1,95 0,77±0,33 0,75 – 0, ХрA 2,70 2,29 – 3,00 0,00 4,50 2,67±0,69 2,59 – 2, Для Курской популяции его значение составило 19,31±1,81 у.е. (95% CI 19,17 19,45 у.е.) и варьировало от 14,85 до 25,90 у.е. Значение медианы составило 19,24 у.е.
и было смещено от средней величины в меньшую сторону;
50% всех значений нахо дилось в интервале от 17,95 до 20,60 у.е. (нижний и верхний квантили). Для хромосом группы D уровень ФАРГ составил 11,50 у.е., для хромосом группы G – 7,75 у.е., ко личество активных РЦ в 50% случаях варьировало от 8 до 9, но, как правило, состав ляло 8,5. Количество ассоциаций акроцентрических хромосом на клетку было 0,7, при этом количество взаимодействующих хромосом приближалось к трем (Ме=2,7) и сильно смещена к верхнему квантилю).
Сравнительный анализ показатеей ФАРГ между мужчинами и женщинами ста тистически значимых различий в средних и медианных значениях ни по одному пока зателю не выявил (таблица 2). В связи с этим дальнейший сравнительный анализ по казателей функциональной активности рибосомных генов проводился без разделения по полу.
Таблица 2.
Уровень ФАРГ в популяции при сегрегации по полу (N м = 346, N ж = 309) Группы Ме р* Q25- Q75 Min Max ФАРГ М 19,30 17,95 – 20,62 15,46 25, 0, Ж 19,18 17,90 – 20,55 14,85 25, ФАРГ по хромосомам группы D М 11,70 10,98 – 12,45 8,40 15, 0, Ж 11,50 10,50 – 12,45 8,40 15, ФАРГ по хромосомам группы G М 7,83 6,83 – 8,82 4,10 10, 0, Ж 7,70 6,70 – 8,90 4,10 11, Количество активных РЦ М 8,50 8,10 – 9,00 6,25 10, 0, Ж 8,50 8,10 – 9,00 5,40 10, Количество ассоциаций хромосом (AХр) М 0,75 0,58 – 1,00 0,00 1, 0, Ж 0,70 0,55 – 1,00 0,00 1, Количество хромосом в ассоциациях (ХрA) М 2,73 2,31 – 3,00 0,00 4, 0, Ж 2,69 2,18 – 3,07 0,00 4, р* - уровень значимости для коэффициента Манна-Уитни Был определён уровень ФАРГ отдельно для детского (до 18 лет, n=107 человек) и взрослого (n=548 человек) населения (таблица 3). Для детской группы он составил Ме=19,60 у.е. и был выше показателей взрослой группы (Ме=19,15 у.е), однако, ста тистически значимого уровня не достигал (р=0,21). Выявленные различия были обу словлены более высоким в детской группе показателем ФАРГ по хромосомам группы D (р=0,001), высокой активностью ассоциирующих хромосом (р=0,001) и большим количеством ассоциаций (р=0,001), а также более узкими границами варьирования этих признаков, чем во взрослой группе. Различий в средних величинах и в степени варьирования показателей ФАРГ по хромосомам G-группы и количеству активных рибосомных цистронов не обнаружено.
Для для более детального изучения механизмов функционирования комплекса рибосомных генов была проанализирована динамика его показателей в различных возрастных подгруппах. В основу разделения была взята классификации, предложен ная ВОЗ (таблица 4).
В рассматриваемой популяционной выборке были представлены все возрас тные группы кроме последней – долгожители, а грудной возраст (11 месяцев) встре чался только в двух случаях и при расчетах был отнесен ко второй группе.
Таблица 3.
Уровень ФАРГ в детской и взрослой группах (Дети=107, N взрослые=548) Группы Ме р* Q25- Q75 Min Max ФАРГ Дети 19,60 18,40 – 20,50 15,90 25, 0, Взрослые 19,15 17,77 – 20,66 14,85 25, ФАРГ по хромосомам группы D Дети 11,90 11,10 – 12,80 8,70 14, 0,001* Взрослые 11,50 10,60 – 12,40 8,40 15, ФАРГ по хромосомам группы G Дети 7,60 6,60 – 8,35 4,10 10, 0, Взрослые 7,83 6,85 – 8,89 4,10 11, Количество активных РЦ Дети 8,60 8,25 – 9,00 7,20 10, 0, Взрослые 8,50 8,09 – 9,00 5,40 10, Количество ассоциаций хромосом (AХр) Дети 0,90 0,65 – 1,10 0,00 1, 0,001* Взрослые 0,70 0,50 – 1,00 0,00 1, Количество хромосом в ассоциациях (ХрA) Дети 2,83 2,43 – 3,20 0,00 4, 0,001* Взрослые 2,60 2,00 – 3,00 0,00 4, р* - уровень значимости для коэффициента Манна-Уитни Таблица 4.
Возрастная периодизация по ВОЗ и количественная представительность в контроль ной группе Группа Период Пол Возраст Пол Возраст N грудной 1 0-1 0-1 раннее детство 2 1–3 1–3 первое детство 3 4–7 4–7 второе детство м 8 – 12 ж 8 – 4 подростковый м 13 – 16 ж 12 – 5 юношеский м 17 – 21 ж 16 – 6 зрелый 1 м 22 – 35 ж 21 – 7 зрелый 2 м 36 – 60 ж 36 – 8 пожилой м 61 – 74 ж 56 – 9 старческий 10 75 – 90 75 – 90 долгожители 11 90 90 Рассчитанные показатели ФАРГ для различных возрастных групп представле ны в таблице 5 и рисунках 1-6.
Установлено, что в целом суммарный уровень ФАРГ с возрастом постепенно снижается, однако данные колебания для популяции статистической выраженности не имеют (р=0,25), достоверные различия наблюдаются лишь между группой лиц по жилого возраста и старческой группой (р=0,03), причем они были обусловлены изме нением ФАРГ только в хромосомах группы D (р=0,05). Показатель ФАРГ по хромо сомам группы G при этом проявлял относительную стабильность (р=0,27).
ФАРГ ФАРГ D Median Median 25%-75% 25%-75% 14 Non-Outlier Range Non-Outlier Range 2 3 4 5 6 7 8 9 10 2 3 4 5 6 7 8 9 Outliers Outliers Группы по возрасту Группы по возрасту 1. 2.
12 ФАРГ G РЦ Median 25%-75% Median Non-Outlier Range 25%-75% Outliers Non-Outlier Range 2 3 4 5 6 7 8 9 10 5 Extremes Outliers 2 3 4 5 6 7 8 9 Группы по возрасту 3. 4.
2. 2. 1. 1. 1. 1. ХАс АсХ 1. 0. 0. 0. 0. 0.0 Median Median 25%-75% 25%-75% Non-Outlier Range Non-Outlier Range - -0. Outliers Outliers 2 3 4 5 6 7 8 9 2 3 4 5 6 7 8 9 Extremes Extremes Группы по возрасту Группы по возрасту 5. 6.
Рисунок 1-6. Показатели комплекса ФАРГ в различных возрастных группах популяции Курской области: 1 – ФАРГ по 10 хромосомам;
2 – ФАРГ по хромосомам группы D;
3 – ФАРГ по хромосомам группы G;
4 – количество активных рибосомных цистронов;
5 – количество ассоциаций хромосом;
6 – количество хромосом в ассо циациях.
Количество активных рибосомных цистронов, количество ассоциаций акроцен трических хромосом и количество хромосом в ассоциациях в популяции изменяются статистически значимо (во всех случаях р0,01). Наибольшая вариабельность для по казателей РЦ наблюдается между подростковым и юношеским периодами (р=0,02) и периодами первой и второй зрелости (р=0,03), для количества ассоциаций – также между периодами первой и второй зрелости (р=0,01) и между зрелым и пожилым воз растом (р=0,01). Количество хромосом в ассоциациях значительно снижается после периода второго детства (р=0,02).
Таблица 5.
Распределение медианных значений показателей комплекса ФАРГ по возрастам Группы р* 2 3 4 5 6 7 8 9 N 5 23 48 31 15 84 122 216 ФАРГ 10 19,75 19,60 19,53 19,35 19,00 19,00 19,49 19,45 19,05 0, ФАРГ D 11,95 12,00 11,90 11,90 12,00 11,37 11,65 11,55 11,40 0, ФАРГ G 7,80 7,60 7,60 7,45 7,40 7,53 8,00 7,95 7,70 0, РЦ 8,60 8,50 8,60 8,70 8,88 8,85 8,50 8,35 8,40 0,01* AХр 1,05 1,00 0,90 0,70 0,60 0,60 0,65 0,75 0,70 0,01* ХрA 2,44 2,90 2,97 2,67 2,85 2,50 2,60 2,75 2,88 0,01* р* - статистчиески значимые различия внутри групп по Краскалу-Уолису 2. Анализ особенностей внутрикомплексного взаимодействия показателей функциональной активности рибосомных генов в курской популяции Для выявления внутригрупповой сопряженности цитогенетических показате лей был проведен корреляционный анализ, рассчитанные по Спирману коэффициен ты представлены в таблице 6.
Таблица 6.
Коэффициенты парных корреляций показателей ФАРГ в общей выборке КО 10 Ag D G RC AsCr CrAs 10 Ag 1, D 1, 0,60* G 1, 0,71* -0,10* RC 1, 0,39* 0,19* 0,32* AsCr 0,06 1, 0,13* 0,10* 0,10* CrAs 0,06 0,04 0,02 -0,05 1, 0,58* р*-статистически значимые коэффициенты Таблица 7.
Коэффициенты парных корреляций показателей ФАРГ в детской выборке КО AG D G RC AsCr CrAs AG 1, D 0,60* 1, G 0,63* -0,24* 1, RC 1, 0,59* 0,24* 0,48* AsCr -0,01 -0,01 -0,07 -0,07 1, CrAs 0,03 0,04 -0,04 0,12 1, 0,59* р*-статистически значимые коэффициенты Таблица 8.
Парные корреляции показателей ФАРГ во взрослой выборке КО AG D G RC AsCr CrAs AG 1, D 0,61* 1, G 0,72* -0,06* 1, RC 1, 0,37* 0,18* 0,30* AsCr 0,16* 0,10* 0,11* 1, 0,13* CrAs 0,04 -0,01 0,06 -0,08 1, 0,55* р*-статистически значимые коэффициенты Таблица 9.
Модель дискриминации по показателям ФАРГ между детской и взрослой выборками КО Признак Ценность признака p АсХ 21,79 0,001 Wilks' Lambda: 0, F (3,283)=16,57, p 0, ФАРГ D 15,34 0, РЦ 13,75 0, Вероятность отнесения 69% Одним из информативных показателей комплекса функциональной активности рибосомных генов является количество активных рибосомных цистронов. Анализи руя его динамику в сочетании с показателями ФАРГ по D и по G хромосомам, можно проследить изменения соотношения их вклада в общий уровень суммарной активно сти РГ.
Особенности двух рассматриваемых возрастных групп были определены также и при анализе корреляционных взаимосвязей. Так, во взрослой выборке, возрастной диапазон которой был более широким и варьировал от 18 лет до 94 лет, также была детектирована корреляционная взаимосвязь отрицательной направленности между показателем количества активных рибосомных цистронов и показателем возраста (R= - 0,26), отсутствовавшая в детской выборке, что указывает на причину относительно го снижения уровня ФАРГ. А более высокий коэффициент корреляции между коли чеством активных рибосомных цистронов и показателем ФАРГ по D хромосомам в рассматриваемой выборке может быть объяснён возможный механизм подобного снижения. В то время как в детской выборке зависимость уровня ФАРГ по G-группе от количества активных рибосомных цистронов была выше.
3. Уровень внутрикомплексной сопряженности показателей функцио нальной активности рибосомных генов при трех патогенетически самостоятель ных мультифакториальных заболеваниях: детских церебральных параличах, детских аллергозах и патологии лёгких Впервые в нашем исследовании были изучены особенности показателей ком плекса функциональной активности рибосомных генов при нескольких самостоятель ных патологиях: детских церебральных параличах, детских аллергозах, хронической обструктивной болезни лёгких.
Было установлено, что в выборке детей с ДЦП (n=87) преобладали низкоко пийные индивиды. Уровень ФАРГ составил 18,69±1,79 у.е. (95% CI 18,31-19,07 у.е., Ме=18,75 у.е.) и был значительно ниже, чем популяционное значение для этого же возраста (р=0,003). Данное снижение обусловлено более низким уровнем ФАРГ по хромосомам группы D (р=0,0001) и одновременно снижением количества активных рибосомных цистронов (p=0,03). Показатель же ФАРГ по хромосомам группы G практически не отклонялся от популяционного значения, как по средним, так и по крайним величинам. Также было установлено, что на уровень общей функциональной активности рибосомных генов у детей, больных ДЦП в большей степени влияют ак тивные рибосомные гены, локализованные в хромосомах G-группы (R=0,75), чем ге ны, локализованные в хромосомах группы D (R=0,70).
В выборке детей с аллергопатологией (n=293) распределение индивидов по ко пийности не отличалось от контрольной группы. Средний показатель суммарной функциональной активности рибосомных генов по 10 хромосомам также не отличал ся от популяционных величин и составлял 19,20±1,75 у.е. (95% CI 19,00– 19,40 у.е., Ме=19,00 у.е.), однако его значение было заметно снижено, а уровень статистически значимых различий почти достигал критического (р=0,06). Подобный эффект наблю дался за счет снижения показателя активности рибосомных генов по хромосомам группы D (р=0,001). Значение показателя ФАРГ по хромосомам группы G, а также количество активных рибосомных цистронов в данной выборке по сравнению с кон тролем не изменялось. Вместе с этим выявлена тенденция к увеличению уровня ФАРГ по G хромосомам (р=0,08). Границы варьирования признака также были сме щены в большую сторону относительно контрольных значений, однако статистически значимой разницы не обнаружено (р=0,12). Анализ взаимосвязи цитогенетических характеристик внутри выборки детей с аллергозами и популяционной выборки дет ского населения демонстрировал ряд некоторых особенностей. Также как и в кон трольной группе в группе детей с аллергопатологией не было установлено статисти ческой зависимости от возраста ни по одному из рассматриваемых показателей ком плекса ФАРГ и показатель количества активных рибосомных цистронов вносил больший вклад в формирование показателями уровня ФАРГ по хромосомам группы G хромосомам (R=0,44), чем по хромосомам группы D (R=0,33). Однако, в формирова ние общего уровня функциональной активности рибосомных генов больший вклад вносил уровень ФАРГ по хромосомам группы G (R=0,66), чем по хромосомам группы D (R=0,59).
Различий ни по одному из средних значений показателей комплекса ФАРГ у больных с ХОБЛ (n=185) от популяционных данных не обнаружено. Средний показа тель суммарной функциональной активности рибосомных генов по 10 хромосомам у больных с ХОБЛ составил 19,49±2,00 у.е. (95% CI 19,20-19,78 у.е., Ме=19,45 у.е.) и был заметно выше, чем в контроле, однако уровень значимости не достигал принято го в исследовании уровня (р=0,08). При анализе характера распределения признака также наблюдалась относительная гомогенность (р=0,07). По-видимому, данный эф фект достигался за счет накопления в выборке высококопийных индивидов – по срав нению с контролем (р=0,06). Многомерный анализ показателей комплекса функцио нальной активности рибосомных генов у больных с ХОБЛ позволил выявить ряд осо бенностей. Например, была определена взаимосвязь между возрастом и показателем уровня ФАРГ по хромосомам группы D, однако она имела отрицательную направ ленность и невысокую выраженность (R=-0,18). Также было установлено, что в фор мирование общего уровня ФАРГ, в отличие от других анализируемых выборок, боль ший вклад вносят транскрибирующиеся рибосомные гены хромосом группы D (R=0,62), чем хромосомы группы G (R=0,54).
Таблица 10.
Суммарный уровень ФАРГ по 10 хормосомам при различных МФЗ Группы Ме р* N Q25- Q75 Min Max ДЦП* 87 19,60 18,40 – 20,50 15,15 22,60 0,001* Аллергозы 293 18,75 17,25 – 20,10 15,00 24,90 0, БА* 114 18,85 17,90 – 20,00 15,00 23,65 0,01* АД 93 19,50 18,50 – 21,25 15,46 24,90 0, АР* 86 18,74 17,90 – 19,90 15,60 24,10 0,01* Заболевания лёгких 185 19,45 18,00 – 20,80 15,28 24,84 0, ХОБЛ* 75 19,85 18,50 – 21,42 16,40 23,90 0,001* проф. бронхит 110 19,04 17,85 – 20,40 15,28 24,84 0, р*0,05 – уровень значимости для коэффициента Манна-Уитни Таблица 11.
Уровень ФАРГ по хормосомам группы D при различных МФЗ Группы Ме р* Q25- Q75 Min Max ДЦП* 11,25 10,40 – 11,95 8,13 13,80 0,001* Аллергозы* 11,40 10,60 – 12,25 7,80 15,90 0,001* БА* 11,20 10,40 – 12,00 7,80 13,95 0,001* АД 11,90 10,71 – 12,50 8,00 15,90 0, АР* 11,37 10,85 – 12,05 8,50 14,50 0,001* Заболевания лёгких 10,67 10,67 – 12,65 6,90 16,20 0, ХОБЛ* 12,00 11,05 – 13,00 6,90 16,20 0,01* проф. бронхит 11,50 10,33 – 12,00 8,50 15,00 0, р*0,05 – уровень значимости для коэффициента Манна-Уитни Таблица 12.
Уровень ФАРГ по хормосомам группы G при различных МФЗ Группы Ме р* Q25- Q75 Min Max ДЦП 7,60 6,70 – 8,50 4,50 10,40 0, Аллергозы 7,88 6,83 – 8,70 3,25 12,00 0, БА 7,75 6,75 – 8,48 3,25 11,10 0, АД* 8,10 7,30 – 9,25 3,50 11,20 0,001* АР 7,63 6,50 – 8,50 4,00 12,00 0, Заболевания лёгких 7,95 7,00 – 8,80 2,50 11,50 0, ХОБЛ 8,05 7,00 – 9,00 4,50 11,50 0, проф. бронхит 7,80 7,00 – 8,70 2,50 10,10 0, р*0,05 – уровень значимости для коэффициента Манна-Уитни Таблица 13.
Количество активных рибосомных цистронов при различных МФЗ Группы Ме р* Q25- Q75 Min Max ДЦП* 8,85 8,30 – 9,38 6,45 10,00 0,03* Аллергозы 8,60 8,20 – 8,60 6,80 10,00 0, БА 8,63 8,18 – 9,00 6,80 9,90 0, АД 8,53 8,18 – 9,00 7,00 9,80 0, АР 8,57 8,25 – 9,00 7,25 10,00 0, Заболевания лёгких* 8,80 8,30 – 9,20 6,90 10,00 0,001* ХОБЛ* 8,95 8,50 – 9,40 6,90 10,00 0,001* проф. бронхит 8,60 8,20 – 9,00 7,05 9,67 0, р*0,05 – уровень значимости для коэффициента Манна-Уитни Таблица 14.
Количество ассоциаций хромосом при различных МФЗ Группы Ме р* Q25- Q75 Min Max ДЦП* 0,60 0,30 – 0,80 0,00 1,35 0,001* Аллергозы* 0,80 0,50 – 1,00 0,00 2,00 0,01* БА* 0,75 0,50 – 0,90 0,00 1,70 0,001* АД* 0,80 0,50 – 1,05 0,00 2,00 0,03* АР 0,90 0,60 – 1,20 0,00 1,60 0, Заболевания лёгких* 0,90 0,67 – 1,08 0,00 1,70 0,001* ХОБЛ* 1,00 0,80 – 1,20 0,00 1,67 0,001* проф. бронхит 0,75 0,60 – 1,00 0,20 1,70 0, р*0,05 – уровень значимости для коэффициента Манна-Уитни Таблица 15.
Количество хромосом в ассоциациях при различных МФЗ Группы Ме р* Q25- Q75 Min Max ДЦП* 2,50 2,20 – 2,86 0,00 4,67 0,001* Аллергозы 2,75 2,33 – 3,20 0,00 4,67 0, БА* 2,71 2,25 – 3,00 0,00 4,29 0,04* АД 2,69 2,25 – 3,20 0,00 4,38 0, АР 2,95 2,55 – 3,25 0,00 4,67 0, Заболевания лёгких 2,67 2,20 – 3,00 0,00 4,50 0, ХОБЛ* 2,80 2,43 – 3,00 0,00 4,20 0,03* проф. бронхит 2,50 2,00 – 2,86 2,00 4,50 0, р*0,05 – уровень значимости для коэффициента Манна-Уитни Таким образом, статистически значимых различий по уровню функциональной активности рибосомных генов в рассматриваемых выборках, за исключением выбор ки детей с ДЦП, по сравнению с контролем обнаружено не было. Однако для каждой выборки были выявлены свои особенности взаимодействия внутри комплекса раз личных показателей функциональной активности рибосомных генов, позволяющие в некоторой степени компенсировать потенциальные уклонения от популяционной «нормы». При этом наиболее вариабельными были уровень ФАРГ по хромосомам группы D и количество активных рибосомных цистронов и наиболее стабильным – уровень ФАРГ по хромосомам группы G.
4. Популяционная распространенность полиморфных вариантов генов факторов транскрипции рибосомных генов и генов ферментов биотрансформа ции ксенобиотиков среди русских жителей Курской области Российской Федера ции Впервые в нашем исследовании было проведено генотипирование и расчет час тот встречаемости аллелей и генотипов для трех полиморфизмов трех генов факторов транскрипции рибосомных генов среди жителей Курской области. Рассчитанные час тоты для общепопуляционной выборки, а также отдельно для групп детей и взрослых представлены в таблице 16 и 17.
Таблица 16.
Распределение аллелей генов в общепопуляционной выборке контроля, выборке де тей и взрослых Поли- Частоты аллелей Алле- Ген мор- Об- Взрос (р) ли Дети n n n физм щая лые 0 1 2 3 4 5 6 72 R 0,656 0,589 0,673 3, 1 Tp53 72 RP 371 73 0,327 (0,06) 72 P 0,344 0, DNMT 149 149 C 0,580 0,599 0,576 0, 2 640 126 3B CT 0,424 (0,50) 149 T 0,420 0, 6A 0,505 0,531 0,500 0, 3 TAF 1B 6 AC 555 81 0,500 (0,47) 6C 0,495 0, 462 462 I 0,918 0,929 0,914 0, 4 CYP1A1 657 175 IV 0,085 (0,39) 462 V 0,082 0, 113 113 Y 0,636 0,659 0,623 1, 5 EPHX1 398 145 YH (0,31) 113 H 0,364 0,341 139 139 H 0,621 0,792 0,801 0, 6 EPHX1 640 166 HR 0,199 (0,74) 139 R 0,379 0, 105 105 I 0,702 0,738 0,688 2, 7 GSTP 615 164 IV 0,321 (0,10) 105 V 0,298 0, Вариантные аллели (мутации) представлены в нижних ячейках соответствующих ДНК-маркёров, уровни значимости р частот аллелей между группами (*р0,05) Как видно из представленных данных, полиморфизм генов факторов транс крипции РГ и ферментов детоксикации у русских жителей Центрально-Чернозёмного региона России характеризуется широким аллельным разнообразием. Уровень на блюдаемой гетерозиготности варьировал от Но=0,12-0,16 для полиморфизма 462 IV гена CYP1A1 различных выборок до Но=0,55-0,57для полиморфизма 6 AC гена TAF 1B. Достаточно высокие значения уровня наблюдаемой гетерозиготности отмечены также для полиморфизмов 72 RP Tp53 и 149 СT гена DNMT 3B. Средний уровень наблюдаемой гетерозиготности наблюдался для полиморфизмов: 139 HR гена EPHX 1 и 105 IV гена GSTP. В целом, по частотам аллелей исследованных полиморфных генов факторов транскрипции РГ и ферментов детоксикации исследуемая популяци онная выборка русских жителей Центрального Чернозёмного региона России не от личалась от других европеоидных популяций.
Таблица 17.
Распределение частот генотипов полиморфизмов генов и их сравнительный анализ в общепопуляционной выборке контроля Частоты генотипов Поли- Геноти № Ген Общая Дети Взрослые морфизм пы n % n % n % 0 1 2 3 4 5 72 RR 155 41,78 27 36,99 128 42, 1 Tp53 72 RP 72 RP 177 47,71 32 43,84 145 48, 72 PP 39 10,51 14 19,18 25 8, 149 CC 197 30,78 41 32,54 156 30, DNMT 2 149 CT 149 CT 349 54,53 69 54,76 280 54, 3B 149 TT 94 14,69 16 12,70 78 15, 6 AA 125 22,52 20 24,69 105 22, 3 TAF 1B 6 AC 6 AC 310 55,86 46 56,79 264 55, 6 CC 120 21,62 15 18,52 105 22, 462 II 556 84,63 151 87,83 405 84, 4 CYP1A1 462 IV 462 IV 94 14,31 23 11,30 71 14, 462 VV 7 1,07 1 0,87 6 1, 113 YY 172 43,22 62 37,65 110 43, 5 EPHX1 113 YH 113 YH 162 40,70 67 52,94 95 37, 113 HH 64 16,08 16 9,41 48 18, 139 HH 409 63,91 105 71,70 304 64, 6 EPHX1 139 HR 139 HR 204 31,88 53 25,47 151 31, 139 RR 27 4,22 8 2,83 19 4, del 259 42,53 68 40,72 191 43, 7 GSTM1 del/+ + 350 57,47 99 59,28 251 56, del 175 28,74 30 17,96 145 32, 8 GSTT1 del/+ + 434 71,26 137 82,04 297 67, 105 II 304 49,43 92 58,10 212 47, 9 GSTP 105 IV 105 IV 255 41,46 58 33,33 197 43, 105 VV 56 9,11 14 8,57 42 9, Проведенный далее сравнительный анализ частот аллелей изучаемых поли морфных вариантов генов в двух возрастных группах общепопуляционной выборки детей (возраст – до 18 лет) и взрослых (возраст после 18 лет) различий по частоте встречаемости ни по одному из рассматриваемых локусов не выявил. Однако, при анализе частот встречаемости различных генотипов было установлено, что частота вариантных гомозигот РР гена Тр53 у взрослых была ниже, чем у детей, при 2=7,26, р=0,007 (OR=2,52;
95% CI 1,20-5,57). Напротив, частота встречаемости мутантного генотипа НН гена эпоксидгидролазы ЕРНХ 1 (113 YH), во взрослой группе была вы ше, чем в детской, при 2=4,30, р=0,04 (OR=0,53;
95% CI 0,28-1,00). Различия в часто тах встречаемости также были обнаружены и для двух полиморфизмов семейства глутатион–S–трансфераз – GSTT1 и GSTР. В первом случае частота встречаемости делеционного генотипа во взрослой группе была статистически значимо выше, чем в группе детей, 2=13,04, р=0,001 (OR=0,45;
95% CI 0,28-0,71), во втором – частота ди кого генотипа II с возрастом уменьшалась 2=3,98, р=0,06 OR=1,44;
95% CI 0,99 2,10). Статистически значимых различий в частотах других полиморфных вариантов генов факторов транскрипции РГ и ферментов детоксикации между группами младше и старше 18 лет не установлено.
Таблица 18.
Распределение аллелей генов в общепопуляционной выборке контроля у мужчин и у женщин Полимор- Частоты аллелей Аллели1 2 (р) № Ген физм М Ж n n 0 1 2 3 4 5 72 R 0,656 0,655 0, 1 Tp53 72 RP 179 (0,95) 72 P 0,344 0, 149 C 0,593 0,575 0, 2 DNMT 3B 149 CT 328 (0,51) 149 T 0,407 0, 6A 0,507 0,502 0, 3 TAF 1B 6 AC 291 (0,87) 6C 0,493 0, 462 I 0,908 0,933 2, 4 CYP1A1 462 IV 396 (0,11) 462 V 0,092 0, 113 Y 0,609 0,679 3, 5 EPHX1 113 YH 247 (0,05)* 113 H 0,391 0, 139 H 0,803 0,792 0, 6 EPHX1 139 HR 378 (0,63) 139 R 0,197 0, 105 I 0,705 0,696 0, 7 GSTP 105 IV 368 (0,74) 105 V 0,295 0, Вариантные аллели (мутации) представл366ены в нижних ячейках соответст вующих ДНК-маркёров, уровни значимости р частот аллелей между группами (*р0,05) Как видно из таблицы 18 различий между частотами встречаемости аллельных вариантов среди мужчин и женщин ни по одному гену не обнаружено. Исключение составил полиморфизм гена EPHX1 в 113 позиции YH. В женской подгруппе му тантный аллель встречался реже (0,321) по сравнению с мужской (0,391), 2=3,91, р=0,05 (OR=0,74;
95% CI 0,54-1,00). Однако, результаты сравнительного анализа час тот генотипов генов факторов транскрипции РГ и ферментов детоксикации статисти чески значимых различий между женской и мужской подгруппами общепопуляцион ного контроля без разделения по возрасту не выявили.
Таблица 19.
Распределение частот генотипов полиморфных вариантов генов в общей выборке контроля у мужчин и у женщин Поли- Геноти- Частоты генотипов р Ген пы морфизм М Ж n n 0 1 2 3 4 5 6 72 RR 0,402 0,432 0,85 0, 1 Tp53 72 RP 179 72 RP 0,508 0,447 1,38 0, 72 PP 0,089 0,121 0,98 0, 0 1 2 3 4 5 6 149 CC 0,317 0,306 0,10 0, DNMT 2 149 CT 328 0,552 149 CT 0,538 0,12 0, 3B 149 TT 0,131 0,156 0,80 0, 6 AA 0,237 0,212 0,50 0, 3 TAF 1B 6 AC 291 6 AC 0,54 0,58 0,09 0, 6 CC 0,223 0,208 0,18 0, 462 II 0,826 0,877 3,22 0, 4 CYP1A1 462 IV 396 0,164 462 IV 0,111 3,61 0, 462 VV 0,01 0,011 0,05 0, 113 YY 0,405 0,477 1,98 0, 5 EPHX1 113 YH 113 YH 247 0,409 151 0,404 0,01 0, 113 HH 0,186 0,119 3,12 0, 139 HH 0,646 0,63 0,17 0, 6 EPHX1 139 HR 139 HR 378 0,315 262 0,324 0,07 0, 139 RR 0,04 0,046 3,02 0, del 0,437 0, 7 GSTM1 del/+ 366 243 0,53 0, + 0,563 0, del 0,516 0, 8 GSTT1 del/+ 366 243 1,27 0, + 0,404 0, 105 II 0,503 0,482 0,26 0, 9 GSTP 105 IV 368 0,405 105 IV 0,429 0,36 0, 105 VV 0,092 0,089 0,02 0, Вариантные аллели (мутации) представлены в нижних ячейках соответствующих ДНК-маркёров.
уровни значимости р частот аллелей между группами (*р0,05) 5. Ассоциации полиморфизмов генов факторов транскрипции рибосомных генов и ферментов детоксикации с предрасположенностью к рассматриваемым мультифакториальным заболеваниям Важным этапом генетико-эпидемиологических исследований мультифактори альных заболеваний является сравнительный анализ частот аллелей и генотипов меж ду группами здоровых и больных, сформированных как гомогенные по этническому составу популяционные выборки неродственных индивидов. Поэтому нами было проведено изучение ассоциаций полиморфных вариантов генов факторов транскрип ции РГ и ферментов детоксикации с предрасположенностью к развитию рассматри ваемых патогенетически самостоятельных мультифакториальных заболеваний: ДЦП, аллергических заболеваниях у детей и при патологии лёгких. В первую очередь был проведен сравнительный анализа частот аллелей и генотипов изучаемых полимор физмов между соответствующими группами здоровых индивидов и группами боль ных, статистическизначимые результаты которого представлены в таблице 20.
Как видно из полученных данных, общая предрасположенность к детским це ребральным параличам ассоциировалась с аллельным вариантом только одного по лиморфного гена – фактора транскрипции рибосомных генов TAF 1B. Частота вари антного аллеля С гена TAF 1B у больных с ДЦП была выше, чем у здоровых индиви дов (OR=1,62;
95%CI 1,03-2,55).
Таблица 20.
Ассоциации аллелей генов факторов транскрипции рибосомных генов и ферментов детоксикации с предрасположенностью к мультифакториальным заболеваниям Частоты аллелей Полимор- 2 (р) Ген Аллели Слу- Кон физм n n чай троль 0 1 2 3 4 5 ДЦП 6A 0,411 0, 1 TAF 1B 6 AC 90 81 4,44 (0,04) 6C 0,589 0, Детские аллергозы 72 R 0,701 0, 2 Tp53 72 RP 211 73 5,72 (0,02) 72 P 0,299 0, Бронхиальная астма 72 R 0,701 0, 3 Tp53 72 RP 87 73 4,39 (0,04) 72 P 0,299 0, 105 I 0,639 0, 4 GSTP 105 IV 147 164 7,03 (0,01) 105 V 0,361 0, Атопический дерматит 72 R 71 0,718 0, 5 Tp53 72 RP 73 5,31 (0,02) 72 P 0,282 0, Аллергический ринит 113 Y 0,500 0,659 10, 6 EPHX1 113 YH 78 (0,01) 113 H 0,500 0, 139 H 0,838 0, 7 EPHX1 139 HR 120 166 2,68 (0,10) 139 R 0,163 0, 105 I 0,808 0, 8 GSTP 105 IV 120 164 3,86 (0,05) 105 V 0,192 0, Патология лёгких 113 Y 0,530 0, 9 EPHX1 113 YH 319 253 9,91 (0,01) 113 H 0,470 ХОБЛ 113 Y 0,554 0, 10 EPHX1 113 YH 156 253 3,71 (0,05) 113 H 0,446 Профессиональный бронхит 6A 0,39 0, 11 TAF 1B 6 AC 86 474 7,11 (0,01) 6C 0,61 0, 113 Y 0,506 0,623 11, 12 EPHX1 113 YH 163 (0,01) 113 H 0,494 1 Вариантные аллели (мутации) представлены в нижних ячейках соответствующих ДНК-маркёров, Общая предрасположенность к аллергозам среди детей ассоциировалась с ал лельным вариантом одного полиморфного гена: геном фактора транскрипции рибо сомных генов Тp 53. Носительство вариантного аллеля 72Р ассоциировалось с пони женным риском развития аллергозов (OR=0,61;
95% CI 0,41-0,92). Также данный ал лель обуславливал пониженный риск развития, как БА (OR=0,61;
95% CI 0,38-0,99), так и АД (OR=0,56;
95% CI 0,33-0,95). Внутри общей группы аллергозов была выяв лена ассоциация вариантного аллеля 113Н гена фермента эпоксидгидролазы 1 с по вышенным риском развития, однако различия в частоте встречаемости не достигали статистически значимого уровня (р=0,06), в то время как в группе детей для АР му тантный аллель повышал риск развития заболевания (OR=1,93;
95% CI 1,27-2,93).
Также мутантный аллель V гена GSTP на развитие различных заболеваний влиял по разному, так для БА он повышал риск развития (OR=1,59;
95% CI 1,11-2,27), а для АР – понижал (OR=0,67;
95% CI 0,44-1,00).
Предрасположенность к заболеваниям лёгких ассоциировалась с аллельными вариантами двух полиморфных генов: фактора транскрипции РГ TAF 1B и эпоксид гидролазы EPHX 1. В частности, вариантный аллель 6С гена TAF 1B ассоциировался с повышенным риском развития заболевания в целом для общей группы (OR=1,57;
95% CI 1,11-2,24), в то время как вариантный аллель 113Н гена EPHX 1 обуславливал повышенный риск развития в группе легочных заболеваний (OR=1,46;
95% CI 1,15 1,87) и в группе ХОБЛ (OR=3,44;
95% CI 1,00-1,78), однако в развитии профессио нальных бронхитов он обладал протекторным действием (OR=0,01;
95% CI 0,01-0,02).
В связи с тем, что анализ частот аллелей генов не даёт полного представления о характере взаимосвязи полиморфизмов с предрасположенностью к болезни, было оценено влияние генотипов факторов транскрипции РГ и ферментов детоксикации риск формирования различных клинико-патогенетических состояний изучаемых МФЗ. В таблице 21 представлены частоты генотипов генов факторов транскрипции РГ и ферментов детоксикации, статистически значимо ассоциированные с развитием заболевания, в группах соответствующего контроля и в группах рассматривемых МФЗ.
Так частота встречаемости дикого генотипа II гена GSTP 105 IV у больных с ДЦП была ниже, чем в популяционной группе (OR=0,56;
95% CI 0,32-0,97). Для об щей группы детей с аллергозами различия в частотах встречаемости вариантного ге нотипа были обнаружены лишь для одного полиморфизма – 72RР гена Тр53. Мутант ный генотип РР встречался в группе «случай» реже, чем в группе «контроль» (OR=0,29;
95% CI 0,13-0,67). Для группы детей с БА установлены ассоциации с тремя генотипами двух генов: TAF 1B – дикий генотип АА встречается реже, чем в популя ции (OR=2,12;
95% CI 0,98-4,62), и с двумя генотипами гена GSTP – накопление ди кого генотипа II вело к развитию заболевания (OR=1,91;
95% CI 1,18-3,07), а гетеро зиготного наоборот (OR=0,60;
95% CI 0,37-0,97). В группе детей с АД отмечалось превалирование дикого генотипа гена Тр53 над популяционными значения ми(OR=0,51;
95% CI 0,25-1,00), вместе с этим для генов DNMT 3B и GSTP наблюда лось накопление мутантных генотипов (OR1=0,46;
95% CI 0,21-1,01, OR2=0,44;
95% CI 0,20-0,93). В группе детей с АР отмечено снижение частоты встречаемости дикого генотипа 113 YY гена EPHX1 (OR=2,17;
95% CI 1,14-4,16) и повышение встречаемо сти для мутантного генотипа 113 НН (OR=0,36;
95% CI 0,16-0,79) этого же гена.
При болёзнях лёгочной системы отклонение от популяционных показателей наблюдалось по трем из рассматриваемых генов TAF 1B, EPHX1 и GSTT1. Для пер вых двух генов отличия в общей группе больных были обусловлены вариациями в частотах встречаемости генотипов у больных с профессиональными бронхитами. Для TAF 1B в обоих случаях мутантный генотип СС встречался реже, чем в популяции (OR1=0,33;
95% CI 0,19-0,57 и OR2=0,59;
95% CI 0,38-0,92), для EPHX1 – дикий гено ти YY чаще (OR1=1,79;
95% CI 1,16-2,78 и OR2=1,50;
95% CI 1,06-2,14), а мутатнт ный НН также реже (OR1=0,58;
95% CI 0,36-0,94 и OR2=0,61;
95% CI 0,40-0,92).
Таблица 21.
Ассоциации генотипов генов факторов транскрипции рибосомных генов и ферментов детоксикации с предрасположенностью к мультифакториальным заболеваниям Частоты генотипов Поли- Геноти р Ген Боль- Кон пы морфизм n n ные троль 1 2 3 4 5 6 ДЦП GSTP 105 IV 105 II 43 0,416 58 0,561 4,31 0, Детские Аллергозы Tp53 72 RP 72 PP 19 0,090 32 0,192 9,40 0, Бронхиальная астма TAF 1B 6 AC 6 AA 17 0,134 20 0,247 4,32 0, 105 II 59 0,401 92 0,561 7,91 0, GSTP 105 IV 105 IV 70 0,476 58 0,354 4,81 0, Атопический дерматит Tp53 72 RP 72 RR 38 0,535 32 0,370 3,97 0, DNMT 3B 149 CT 149 TT 19 0,241 16 0,127 4,42 0, GSTP 105 IV 105 VV 23 0,177 14 0,085 5,53 0, Аллергический ринит 113 YY 62 0,256 62 0,428 6,39 0, EPHX1 113 YH 113 HH 16 0,256 16 0,110 7,99 0, Патология лёгких TAF 1B 6 AC 6 CC 44 0,326 105 0,222 6,20 0, 113 YY 108 0,339 110 0,435 5,54 0, EPHX1 113 YH 113 HH 89 0,279 48 0,190 6,17 0, ХОБЛ GSTT1 del/+ del 64 0,218 145 0,328 6,66 0, Профессиональный бронхит TAF 1B 6 AC 6 CC 32 0,372 105 0,222 8,93 0, 113 YY 49 0,301 110 0,435 7,56 0, EPHX1 113 YH 113 HH 47 0,288 48 0,190 5,81 0, Вариантные аллели (мутации) представлены в нижних ячейках соответствующих ДНК-маркёров Предрасположенность к ХОБЛ ассоциировалась лишь с одним генотипом – де леционным вариантом гена GSTT1. Его частота среди больных ХОБЛ была выше, чем среди здоровых индивидов (OR=1,75;
95% CI 1,12-2,75). Статистически значимых различий в частотах генотипов других полиморфных вариантов генов факторов транскрипции рибосомных генов и ферментов детоксикации между группами здоро вых индивидов и больных с МФЗ не установлено.
6. Влияние полиморфизмов генов факторов транскрипции РГ и ферментов детоксикации на показатели функциональной активности рибосомных генов для здоровых жителей Курской области в различных возрастных группах и с учетом полового диморфизма, а также в пределах каждого из рассматриваемых заболеваний Для всех изученных в ходе выполнения настоящего исследования нозологиче ских единиц проанализирована связь показателей функциональной активности рибо сомных генов с генотипами по исследуемым вариантам генов-кандидатов с помощью однофакторного дисперсионного анализа.
Таблица 22.
Статистически значимые ассоциации полиморфизмов генов факторов транскрипции РГ и ферментов детоксикации с показателями функциональной активности рибосом ных генов у жителей Курской области Ген, Группы полиморфизм Общая Мужчины Женщины Дети Взрослые ФАРГ TAF 1B 6 AC 0, EPHX1 139 HR 0, ФАРГ по хромосомам группы G GSTT1 del/+ 0,01* GSTP 105 IV 0, Количество ассоциаций хромосом (AХр) GSTM1 del/+ 0,02* 0,03* GSTP 105 IV 0, Количество хромосом в ассоциациях (ХрA) DNMT 3B 149 CT 0, EPHX1 113 YH 0, GSTP 105 IV 0,03 0, df= В таблицах 22-23 представлены данные о выявленных ассоциациях полиморф ных вариантов генов с показателями уровня функциональной активности рибосомных генов у жителей Курской области в зависимости от генотипов по исследованным ва риантам. Также в таблицах представлены наиболее значимые результаты проведенно го анализа связи других полиморфизмов с количественными характеристиками ком плекса ФАРГ, которые всего лишь определяют тенденцию к ассоциации, но после введения поправки Бонферони статистически значимые связи теряются.
Результаты однофакторного дисперсионного анализа связи полиморфизмов с количественными признаками в общепопуляционной группе свидетельствуют о на личии статистически значимой ассоциации количества активных рибосомных цис тронов с полиморфизмом del/+ гена GSTT1: носителей делеционного генотипа (n=129) по этому локусу отличает повышенный уровень показателя по сравнению с лицами объединенной группы (гетерозиготами и носителями дикого генотипа (n=94)).
Медианное значение показателя количества активных рибосомных цистронов в груп пе гомозигот по делеции гена GSTT1 составило 8,7, распределение в рамках квар тильного интервала варьировало от 8,4 до 9,35 активных цистронов на анализируе мую клетку. В общей группе гетерозигот и доминантных гомозигот медианное значе ние было ниже и составляло 8,43, нижняя и верхняя границы межквартильного ин тервала при этом также были смещены 8,05 – 9,0 цистронов, соответственно.
В общепопуляционной группе, помимо рассмотренной связи, была выявлена лишь одна статистически значимая взаимосвязь – между полиморфным вариантом глютатионовых S-трансфераз - I105V гена GSTP и количественным показателем чис ла хромосом, вступивших в ассоциации.
Таблица 23.
Статистически значимые ассоциации полиморфизмов генов факторов транскрипции РГ и ферментов детоксикации с показателями функциональной активности рибосом ных генов при различных МФЗ Группы Ген, Алл- Пат.лё Проф полиморфизм ДЦП БА АД АР ХОБЛ зы г. ХБ ФАРГ DNMT 3B 149 CT 0,02 0, EPHX1 139 HR 0, ФАРГ по хромосомам группы D Tp53 72 RP 0, DNMT 3B 149 CT 0,01* GSTM1 del/+ 0, GSTP 105 IV 0, ФАРГ по хромосомам группы G DNMT 3B 149 CT TAF 1B 6 AC 0, GSTM1 del/+ 0,04* GSTT1 del/+ 0,05* GSTP 105 IV 0,04 0, Количество активных РЦ DNMT 3B 149 CT 0,01* GSTT1 del/+ 0,05* GSTP 105 IV 0,04 0, Количество ассоциаций хромосом (AХр) CYP1A1 462 IV 0, GSTM1 del/+ 0,04* GSTT1 del/+ 0,05* Количество хромосом в ассоциациях (ХрA) DNMT 3B 149 CT 0, TAF 1B 6 AC 0,04 0, EPHX1 113 YH 0, GSTM1 del/+ 0,02* df= Было показано уменьшение медианного значения ассоциирующих хромосом в зависимости от соответствующего варианта генотипа: у диких гомозигот (n=78) оно составило 2,99 и являлось максимальным, для мутантных гомозигот (n=65) – 2,67 и являлось минимальным, для гетерозигот (n=17) данный показатель был равен 2,77, а значение являлось промежуточным. В последних двух случаях показатели были ниже общепопуляционных данных, где количество ассоциирующих хромосом было зафик сировано на уровне 2,83. Самые низкие границы для межквартильного распределения признака были отмечены также для носителей мутантного (Q25-75 = 2,00-2,86) и ге терозиготного (Q25-75 = 2,77-3,00) генотипов, самые высокие – для носителей дикого генотипа (Q25-75 = 2,77-3,25).
В детской выборке контроля не установлено ни одной статистически значимой ассоциации ни с одним из рассматриваемых полиморфизмов.
Среди исследованных генов факторов транскрипции РГ и ферментов детокси кации ассоциации с количественными признаками в старшей возрастной группе про явили гены GSTT 1 и EPHX 113. При этом «нулевой» генотип (n=76) GSTT 1 был свя зан с повышенным количеством активных рибосомных цистронов (8,90;
Q25-75 = 8,35-9,43) и обуславливал имеющуюся ассоциацию в общепопуляционной группе, т.е.
являлся положительным фактором с точки зрения активации комплекса функцио нальной активности рибосомных генов. В группе со «смешанными» генотипами (n=55) медианное значение количества активных рибосомных цистронов составило 8,45 (Q25-75 = 8,05-9,05).
При изучении влияния полиморфизмов на показатели ФАРГ максимальное ко личество ассоциаций рассматриваемых генов обнаружено в группе детей с цереб ральными параличами. Так, полиморфизм гена DNMT 3B C149T оказывал плейо тропный эффект сразу на несколько показателей: на суммарную функциональную ак тивность рибосомных генов по 10 акроцентрическим хромосомам, на показатели функциональной активности по хромосомам группы D и на общее количество актив ных рибосомных цистронов. Установлено, что носители генотипа 149СС (n=20) обла дали максимально высокими показателями функциональной активности рибосомных генов – 11,65 у.е., и 50 % от всех случаев встречались от 11,23 у.е. до 12,18 у.е. Для гетерозигот (n=43) медианный показатель составил 10,80 у.е. (Q25-75=9,85-11,80 у.е.) и был минимален. Для рецессивных гомозигот (n=16) он достигал значения 11,22 у.е., варьируя в минимальных пределах (Q25-75=10,40-1,55 у.е.).
Распределение значений показателей количества активных рибосомных цис тронов по группам у больных с ДЦП в зависимости от генотипа имело схожий пат терн. Максимальный диапазон варьирования границ межквартильного интервала на блюдался в группе гетерозигот (n=43, Q25-75=8,20-9,20), наиболее минимальный – в группе носителей мутантного генотипа (n=16, Q25-75=8,30-9,05), в группе с диким генотипом он принимал средние значения (n=20, Q25-75=8,78-9,6). Несмотря на это, максимальное количество функционально активных рибосомных цистронов чаще встречалось именно в группе с генотипом С149С и было равно Ме=9,37, в то время как в группе носителей С149Т генотипов этот показатель был минимальным – Ме=8,50 и принимал средние значения в группе с диким генотипом – Ме=8,69.
Среди других цитогенетических характеристик следует отметить показатель уровня суммарной функциональной активности рибосомных генов по десяти хромо сомам. Распределение его значений имело также схожий паттерн, но рассчитанный уровень статистической значимости модели после внесения поправки Бонферони (р=0,066) не достигал принятого в диссертации (р0.05) уровня. Максимальное зна чение признака наблюдалось в группе с С149С генотипом (Ме=19,40 у.е., Q25 75=18,68-20,75 у.е.), минимальное – в группе С149Т (Ме=18,20 у.е., Q25-75=16,70 19,45 у.е.) и средние значения – в группе Т149Т (Ме=18,32 у.е.;
Q25-75=17,25-19, у.е.).
Среди исследованных генов ферментов биотрансформации ассоциацию с коли чественными признаками проявили делеционные полиморфизмы генов глютатион трансфераз: GSTM1 – с показателем функциональной активности рибосомных генов по хромосомам группы G и GSTT1 – с показателя функциональной активности рибо сомных генов по хромосомам D группы и группы G. При этом «нулевой» генотип GSTM1 был связан с пониженным уровнем функциональной активности G хромосом, т.е. являлся негативным фактором транскрипции (n=41, Ме1=7,05 у.е., Q25-75=6,30 7,85 у.е.;
n=38, Ме2=7,65 у.е., Q25-75=7,29-8,80 у.е., соответственно).
«Нулевой» генотип гена GSTT1 по-разному влиял на функциональное состоя ние рибосомных генов D и G групп, оказывая протекторное действие на экспрессию по хромосомам группы D, одновременно являясь антагонистом для G группы. Так, медианное значение показателя функциональной активности рибосомных по D хро мосомам генов в группе больных с ДЦП для носителей делеционного генотипа соста вило 10,50 у.е. (Q25-75=10,30-11,25 у.е.), для объединенной группы гетерозигот и до минантных гомозигот этот показатель был значительно выше – 11,25 у.е. (Q25 75=10,60-11,90 у.е.). В то время как уровень функциональной активности рибосомных генов по хромосомам группы G в группе с мутантными генотипами был выше (8, у.е. Q25-75=6,95-9,50 у.е.), чем в группе с диким аллелем (7,40 у.е. Q25-75=6,70-8, у.е.).
В общей выборке детей с аллергозами выявлено две статистически значимые ассоциации полиморфных вариантов генов с цитогенетическими показателями, таки ми как показателем ассоциативного индекса и показателем уровня функциональной активности по G хромосомам.
Полиморфизм гена цитохрома Р450 (CYP 1А1, I462V) был статистически зна чимо связан с ассоциативным индексом акроцентрических хромосом (р=0,012), му тантный генотип V462V при этом оказывал протекторное действие на интенсивность вступления хромосом в ассоциации. Данную закономерность можно обнаружить, анализируя средние значения ассоциативного индекса. Для носителей мутантного ге нотипа (n=3) этот показатель составил 80,00±17,32%, для гетерозиготного генотипа (n=48) на десять процентов меньше – 69,79±21,59%, для дикого (n=237) – еще на процентов меньше 59,83±24,02%. Однако, медианные значения ассоциативного ин декса для детей с различными генотипами практически не различались (Ме1=70%, Ме2=70%, Ме3=60% соответственно), варьировали лишь границы интерквартильного размаха. Для группы с мутантным генотипом они составили 70-100%, группы гетеро зигот они были сдвинуты в меньшую сторону и составили 60-90%, для группы с ди ким генотипом – 50-80%.
Как видно из представленных в таблице данных, кроме полиморфизма гена ци тохрома Р450 с различными показателями комплекса функциональной активности были ассоциированы полиморфизмы гена DNMT 3B C149T (с суммарным показате лем уровня функциональной активности по 10 хромосомам и показателем по хромо сомам группы G), гена фактора транскрипции TAF 1B A6C (также с суммарным пока зателем уровня функциональной активности рибосомных генов), но данные связи ли бо не достигали принятого в работе уровня статистической значимости, либо также нивелировались после введения поправки Бонферони.
Еще одним полиморфизмом, оказывающим влияние на показатель уровня функциональной активности рибосомных генов на статистически значимом уровне, был полиморфизм делеционного гена GSTT1 (р=0,036). «Нулевой» генотип детерми нировал более низкий уровень функциональной активности рибосомных генов по хромосомам группы D (n=218, Ме=11,25 у.е., Q25-75=10,45-12,20 у.е.), чем в объеди ненной группе гетеро- и гомозигот по дикому аллелю (n=11,68 у.е., Q25-75=11,00 12,30 у.е.).
Анализ связи полиморфизмов рассматриваемых генов с показателями функ циональной активности рибосомных генов у больных с патологией лёгочной систе мы, как в общей группе, так и при ХОБЛ, и при профессиональном бронхите стати стически значимых взаимосвязей не выявил.
7. Особенности проявления связей парных сочетаний генных маркеров с количественными характеристиками комплекса функциональной активности рибосомных генов в каждой из рассматриваемых групп В первую очередь, необходимо пояснить, что именно мы имеем в виду, упот ребляя термин «количественные признаки», – это некоторые показатели функцио нальной активности рибосомных генов, взятые для цитогенетического анализа, опре деляющие особенности физиологии организма и напрямую связанные, в том числе, и с патологическими состояниями. Крайние их значения – с одной стороны, могут стать причиной заболевания, с другой – являться его следствием. В то же время эти призна ки – обычные цитогенетические параметры любого ядра любой клетки. Характер их изменчивости оказывается не одинаковым в группах с разным состоянием здоровья, у представителей разного пола и возраста, а также может изменяться под воздействием некоторых экзогенных факторов (Иванов В.П. и соавт., 2011 открытие). Влияние этих факторов на вариацию количественных признаков показано для большинства физио логических, антропометрических, биохимических и других показателей (Алексеева, 1986;
Пузырёв В.П., 1991). В процессе эволюции человеческого вида, как и любого другого, происходит образование комплексов взаимосвязанных морфофизиологиче ских признаков, обеспечивающих оптимальное функционирование организма в целом (Шмальгаузен, 1938). Это может означать, что морфофункциональная структура ор ганизма сама по себе в некоторых оптимальных пределах ограничивает вариацию его отдельных признаков. Вместе с этим, пределы варьирования тех или иных признаков ограничены нормой реакции организма и комплексом имеющихся генетических де терминант.
В большинстве случаев доля имеющейся фенотипической изменчивости коли чественных признаков объясняется различиями в аллельном и генотипическом соста ве по исследуемым локусам. Поэтому следующей нашей задачей было изучение влияния парных сочетаний исследуемых генных маркеров на показатели функцио нальной активности рибосомных генов. Для этого был использован многофакторный дисперсионный анализ, в ходе которого мы проверили значимость различий между средними при различных сочетаниях генотипических групп с помощью сравнения дисперсий соответствующих показателей комплекса рибосомных генов. Разделение общей дисперсии на несколько источников (связанных с различными эффектами в плане), позволило сравнить дисперсию, вызванную различием между группами, с дисперсией, вызванной внутригрупповой изменчивостью. Проверяемая гипотеза со стояла в том, что различия между группами отсутствуют. При истинности нулевой гипотезы, оценка дисперсии, связанной с внутригрупповой изменчивостью, должна быть близкой к оценке межгрупповой дисперсии. При ложности - значимо отклонять ся.
Полученные данные представлены в таблице 25 и 26. В качестве анализируе мых факторов нами были рассмотрены различные парные сочетания изучаемых генов факторов транскрипции рибосомных генов и ферментов биотрансформации ксено биотиков, в качестве зависимой переменной – различные показатели комплекса функциональной активности рибосомных генов.
Проведенный анализ влияния парных сочетаний полиморфизмов рассматри ваемых генов факторов транскрипции РГ и ферментов детоксикации на показатели комплекса ФАРГ в общепопуляционной выборке без дискриминации по полу и по возрасту по Курской области выявил статистически значимые взаимосвязи со всеми рассматриваемыми характеристиками.
Установлено, что на общий уровень ФАРГ по 10 хромосомам влияло сочетание полиморфизмов генов DNMT 3B C149T / TAF 1B A6C. Критерий Фишера для данной модели составил F(4, 255)=2,45, при p=0,05. Максимальный размах варьирования ФАРГ наблюдался при сопряжении двух мутантных генотипов, при этом среднее зна чений признака было равно 20,63±0,70 у.е., а границы доверительного интервала со ставили 19,25 – 22,01 у.е. Квадрат множественного коэффициента корреляции для данной модели составил R2=0,05.
Таблица 25.
Зависимость показателей ФАРГ при парном сочетании изучаемых полиморфизмов в популяции жителей КО Признак Общая Дети Взрослые DNMT 3B C149T / TAF 1B ФАРГ A6C (0,05) DNMT 3B C149T / GSTM1 DNMT 3B C149T / ФАРГ D del/+ (0,05) GSTP I105V (0,045) CYP1A1 I462V / GSTT1 CYP1A1 I462V / ФАРГ G del/+ (0,02) GSTT1 del/+ (0,02) Tp53 R72P / DNMT 3B Tp53 R72P / DNMT 3B C149T (0,03) C149T (0,04) DNMT 3B C149T/ TAF 1B DNMT 3B C149T / A6C (0,04);
TAF 1B A6C (0,01);
РЦ TAF 1B A6C / GSTM1 CYP1A1 I462V / del/+ (0,05);
GSTT1 del/+ (0,015);
CYP1A1 I462V / GSTT1 GSTT1 del/+/ GSTP del/+ (0,03);
I105V (0,03) DNMT 3B C149T / EPHX1 DNMT3B C149T / H139R (0,05);
GSTT1 del/+ (0,05) АсХ TAF 1B A6C / EPHX Y113H (0,02) Tp53 R72P / TAF 1B A6C Tp53 R72P / TAF 1B (0,01);
A6C (0,01) TAF 1B A6C / EPHX ХАс Y113H (0,02);
TAF 1B A6C / GSTP I105V (0,05) На уровень показателей ФАРГ по хромосомам группы D оказывало влияние сопряжение генов DNMT 3B C149T / GSTM1 del/+. Значение критерия Фишера для данной модели составило F(2, 199)=3,14, при p=0,05. Максимальное варьирование по казателей было отмечено при сочетании мутантного генотипа Т149T гена деметил трансферазы 3В как с «нулевым» генотипом GSTM1 (95% CI 11,19 – 12,61 у.е.), так и с группой «смешанных» генотипов (95% CI 10,83 – 12,20 у.е.), при этом более высо кие значения средних величин, равно как и границы варьирования, были ассоцииро ваны с совокупным эффектом мутантных генотипов. Однако значение квадрата мно жественного коэффициента корреляции (R2=0,05) говорит о наличии других возмож ных факторах сопряжения, влияющих на выявленную изменчивость.
На уровень ФАРГ по хромосомам группы G оказывало влияние сочетание ге нов CYP1A1 I462V / GSTT1 del/+, при F(2, 213)=4,22, а p=0,02. Максимальная вариа бельность признака наблюдалась также при сочетании двух мутантных генотипов (95% CI 6,07 – 11,67 у.е.), максимальное среднее значение (М=8,87±1,42 у.е.) выявле но также при данном сочетании.
На показатели количества активных рибосомных цистронов оказывали влияние сразу несколько парных сочетаний рассматриваемых генов. Это полиморфизмы генов Tp53 R72P / DNMT 3B C149T (F(4, 102)=2,76, p=0,03), генов DNMT 3B C149T / TAF 1B A6C (F(4, 239)=2,52, p=0,04), генов TAF 1B A6C / GSTM1 del/+ (F(2, 194)=3,06, p=0,05) и генов CYP1A1 I462V / GSTT1 del/+ (F(2, 213)=3,48, p=0,03).
Таблица 26.
Зависимость показателей ФАРГ при парном сочетании изучаемых полиморфизмов в группах с МФЗ Признак ДЦП Аллергозы Патология лёгких TAF 1B A6C / GSTT1 Tp53 R72P / EPHX del/+ (0,03);
H139R (0,02) EPHX1 H139R/ GSTM1 Tp53 R72P / GSTT ФАРГ del/+ (0,03) del/+ (0,04);
GSTT1 del/+ / GSTP I105V (0,03) Tp53 R72P / TAF 1B Tp53 R72P / GSTT EPHX1 H139R / A6C (0,01);
del/+ (0,04);
ФАРГ D GSTM1 del/+ (0,03);
EPHX1 Y113H / GSTM1 del/+ (0,01) Tp53 R72P / EPHX1 Tp53 R72P / GSTT1 Tp53 R72P / EPHX H139R (0,03);
del/+ (0,01) H139R(0,01) ФАРГ G TAF 1B A6C / GSTT del/+ (0,01) Tp53 R72P / EPHX1 Tp53 R72P/ GSTP Tp53 R72P / EPHX H139R (0,05);
I105V (0,01);
Y113H (0,01);
РЦ Tp53 R72P/ GSTM1 Tp53 R72P/ GSTM del/+ (0,04) del/+ (0,04);